您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2022-06-10 13:30
BCS(生物药剂学分类系统)根据化合物的溶解性和渗透性对化合物进行分类。生物药剂学分类系统的提出旨在于生物豁免,减少对体内生物等效性研究的需求,可以减少不必要的生物等效性研究,加速高质量药品的研发。在化合物众多理化性质及生物学性质中,选择化合物溶解性和渗透性作为评价指标,可见两者对于药物体内吸收,生物利用度和药效的发挥起到举足轻重的作用。
生物药剂学分类系统:
根据BCS对溶解性的分类,即制剂的最大剂量所对应的药物是否能在体积不大于250mL、pH值在1.0~6.8的水溶性介质中完全溶解,能完全溶解即为高溶解性药物,反之则为低溶解性药物。因此,药物的溶解性跟最大使用剂量和溶解度有关,建立测定药物溶解度的方法有助于合理地对药物溶解性进行评价。药物的溶解度在体外很容易可以试验进行获得,而药物的渗透性就显得不易或许。
渗透性分类与API在人体内的吸收程度间接相关(指吸收剂量的分数,而不是全身的生物利用度),与API在人体肠道膜间质量转移速率直接相关,或者也可以考虑其他可以用来预测药物在体内吸收程度的非人体系统(如使用原位动物、体外上皮细胞培养等方法)对渗透性进行分类。当一个口服药物采用质量平衡测定的结果或是相对于静脉注射的参照剂量,显示在体内的吸收程度≥85%以上(并且有证据证明药物在胃肠道稳定性良好),则可说明该药物具有高渗透性。
原料药按照BCS分为四类:
BCS I类:高溶解性-高渗透性;
BCS II类:低溶解性-高渗透性;
BCS III类:高溶解性-低渗透性;
BCS IV类:低溶解性-低渗透性。
药物渗透性评价:Caco2细胞特征
在药物早期开发中,使用体外细胞模型去评价药物体内渗透性可以节省时间和资源,加速药物drug-like评价。其中细胞单层方法是药物发现中最早使用的体外渗透性评价方法,最为为大家所熟知是Caco2。Caco2是可以无限分裂的人结肠癌细胞系,Caco2顶膜表面形成微绒毛形态与胃肠道上皮细胞的小肠绒毛比较相似,且表达众多的细胞转运体,包括p-糖蛋白(p-gp),乳腺癌耐药蛋白(BCRP),多药耐药蛋白(MPR)等常见的外排型转运蛋白,还包括葡萄糖,氨基酸,寡肽等参与物质转运的吸收型蛋白。
小肠上皮细胞线粒体中存在药物代谢酶CYP3A4,其为肝中CYP3A4活性的70%。正常情况下,Caco2细胞代谢酶表达水平比较低,其中CYP3A4的表达水平也不明显,这样Ccao2细胞无法真实指明药物在胃肠道的系前代谢情况。有研究表明,可以通过药物的刺激或者CYP3A4基因的转染,来提高Caco2细胞中CYP3A4的表达。Ccao2细胞的结构,转运体及代谢酶与胃肠道上皮细胞相似,比较靠近真实的胃肠道药物可能“遭受”的吸收与代谢情况,进而用于预测药物体内的渗透性情况。
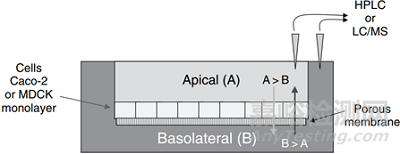
图1 单层Caco2细胞渗透性试验装置(来源于参考文献2)
图1为细胞的渗透性试验装置,将细胞置于上述装置中,培养细胞生长连接成片,铺满整个多孔的滤膜。随着时间推移,细胞将形成微绒毛,并表达众多的转运体。测定代谢两到三周可以加入1a-25-二羟基维生素D诱导CYP3A4的表达。理想状态形成单层细胞单层,也可能形成细胞单层与细胞多层的混合。细胞之间一定不能存在缝隙,否则化合物将通过缝隙通过多空滤膜。
Caco2细胞评价药物渗透性试验设计:
利用这项技术可以进行多种不同的渗透性实验。最简单的实验是将被试化合能人到加胞单层的顶膜侧(A)缓冲液中,基底侧(B)缓冲液中则不含被试化合物,试化合物从顶膜侧隔室穿过细胞,扩散到基底侧隔室。在1~2小时之后的某个特定到问点,分别从两侧隔室取一定量的样品,采用HPLC或液相色谱-质谱法(LC/MS)两侧被试化合物的浓度,计算渗透速率。这种从顶膜侧到基底侧的扩散试验(A→B)得到吸收方向的渗透速率,可以模拟胃肠道的吸收。一些研究小组已将上述渗透速率(P)与小肠吸收或剂量吸收百分比(FA)关联起来。这种相关性一旦建立,即可以帮助药物化学家预测其化合物在体内的吸收。
另一种实验是将含被试化合物的缓冲液置于细胞单层基底侧,不含被试化合物缓冲液置于顶膜侧,该实验用于研究被试化合物依赖细胞膜转运体的渗透性。如果A-B方向的渗透性(PA-B)与B→A方向的渗透性(PB-A)相同,那么该化合物主要通过被动扩散渗透;如果两个方向的渗透速率存在显著差异,则可能有转运体参与渗透。一般认为,如果PA-B大于PB-A且PA-B/PB-A≥2,表明化合物可能经主动转运摄取。如果PA-B小于PB-A且PB- A/PA-B≥2,表明化合物可能经主动转运外排。
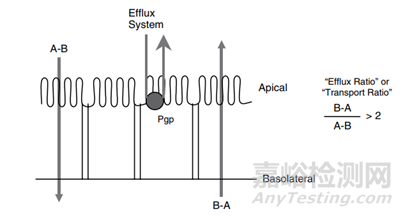
图2 Cell layer efflux assays measure the permeability both the apical to basolateral (A-B) and basolateral to apical (B-A) directions and calculate an efflux or transport ratio. A ratio >2 indicates efflux. (来源于参考文献2)
细胞单层渗透性测定一直采用多种条件,一些需要考虑的重要变量包括被试化合物浓度、顶膜侧和基底侧隔室水相缓冲液的pH、基底侧隔室隔绝被试化合物所使用的材料和顶膜侧隔室助溶剂的使用。
Caco-2渗透性测定值存在实验室的差异,但有时也需要制定一个标准去表征测试化合物的渗透性强弱:
低渗透性:Papp<2*10-6cm/s
中等渗透性:2*10-6cm/s <Papp<20*10-6cm/s
高渗透性:20*10-6cm/s <Papp
Caco2模型的验证
由于Caco2转运体表达的差异,可能造成实验室的测定数值的存在区别,每个实验室都应建立明确外排转运和摄取转运的比值,进行方法的验证,通过对已知底物进行测试并对得到的数值进行比较。大多数公司,使用质控化合物进行实验,分别验证Caco2细胞对于化合物的外排(例如地高辛),细胞旁路渗透(阿替洛尔),被动转运(普萘洛尔),这样以确保建立模型可靠性。Caco2细胞表达多个转运体,对于可以通过同时被多个转运体转运的化合物来说,这样可能造成转运结果难以判断,除非使用特异性抑制剂进行对照试验。
尽管Caco2细胞模型尚存在不足,比如:
细胞培养时间过长(21d),培养过程需要不断地更换培养液,成本高;
细胞模型本身为纯细胞系,缺乏在小肠上皮细胞中的黏液层,无法真实体现胃肠道的真实胃肠道环境;
缺少细胞培养标准以及试验操作标准,使不同试验试验结果差异,使得结果有时缺乏可比性;
由于Caco-2细胞来源于人结肠,因而该细胞的转运特性、酶的表达以及跨膜电阻相对更能反映结肠细胞而非小肠细胞等等。
但是,不可否认的是,建立与应用Caco2细胞模型可以被认为是药物吸收研究方面取得的重要成就,而且随着改进细胞模型的建立和培养装置、检测设备等新技术的应用,其在新药研发中必将发挥出重要作用。药物发现阶段,通过体外的评价手段,可以加快项目的快速推进,节省时间与资源的投入。利用人小肠上皮Caco-2细胞单层来进行药物小肠吸收的细胞水平实验,已经成为一种预测药物在人体小肠吸收以及研究药物转运机制的标准筛选工具。
参考文献:
1.人体生物等效性试验豁免指导原则
2.Drug-like Properties: Concepts, Structure Design and Methods : from ADME to Toxicity(Optimization Permeability Methods/ Transporter Methods)

来源:药事纵横


