您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2021-06-07 13:47
羟基磷灰石(HA)是诱导骨再生的代表物质,本文用聚乙烯亚胺(PEI)包覆从马骨中提取的羟基磷灰石(EH)制成一种比25kD PEI性能更好、毒性更低的新型非病毒基因载体(pEH),将骨形态发生蛋白-2 (BMP-2)基因导入pEH,并将其导入细胞。结果表明,BMP-2/pEH组骨桥蛋白(OPN)、骨钙素(OCN)和矮小相关转录因子2(RUNX2)的表达显著增加,从而促进了成骨细胞的分化。
01研究内容简介
羟基磷灰石(HA)是一种由磷酸钙组成的矿物质,是骨的主要成分。该材料已在组织工程学中用于骨再生。HA可以人工合成,也可以从天然来源获得。我们研究小组发现,从猪或马骨中提取的合成HA和天然HA之间没有显著差异(表1)。表1显示了马骨合成羟基磷灰石和天然羟基磷灰石的元素组成。一般说来,HA被用作骨再生的材料,但我们试图将天然HA修饰成一种基因载体,一种分子生物学工具,同时试图利用这种带有成骨分化特异性基因的新型载体来促进骨分化。
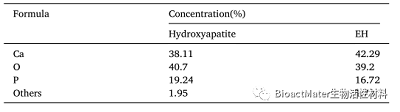
表1马骨合成羟基磷灰石和天然羟基磷灰石的元素组成。
基因转染的方法通常分为使用病毒载体和使用非病毒载体。病毒载体在导入基因方面比其他方法更有效。然而,使用该病毒存在潜在的危险,可能会导致意外的免疫反应或不想要的基因表达。使用非病毒方法主要有两种方式。一种是物理方法,对细胞外部施加物理冲击,从而导入基因。另一种方法是化学方法。磷酸钙、阳离子脂质和阳离子聚合物可以与靶DNA结合或含有目的DNA并穿过细胞膜。这些方法的优点是潜在风险低,但缺点是基因转移效率低。
BMP-2具有良好的骨再生效果。因此,使用BMP-2蛋白治疗骨缺损已经进行了很多研究。此外,通过将BMP-2基因转移到骨缺损部位来进行骨再生的基因治疗也进行了研究。结果观察到骨缺损的恢复。研究人员已经使用阳离子聚合物、腺病毒和质粒来传递BMP-2基因。
在这项研究中,我们不仅尝试使用最具代表性的聚合物25kD PEI和EH的复合物来开发一种新型的基因载体,而且使用BMP-2质粒和我们的基因载体诱导成骨分化。图1显示了这项研究的策略。
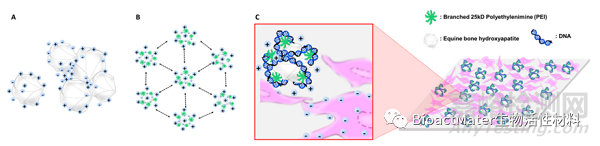
图1.本研究的策略。(A)从马骨中提取的羟基磷灰石在水中往往会聚集在一起。(B)通过在马骨上涂覆 PEI,每个颗粒分布均匀。(C)PEI包覆的马羟基磷灰石(pEH)含有基因,使其更容易进入细胞。
我们用电子显微镜(SEM和TEM)观察了pEH(图3)。结果表明,超声处理的纳米级EH完全没有分散,而是聚集在一起。然而,pEH不仅分布均匀,而且大部分粒径小于500 nm。(图3B)。
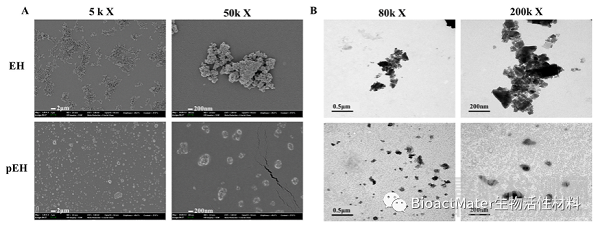
图3电子显微镜的图像分析。(A)EH和pEH的扫描电子显微镜图像((比例尺=2μm和200 nm)。(B)EH和pEH的透射电子显微镜图像(比例尺=0.5μm和2 0 0 nm)。
因此,我们试图确保25kD的PEI正确包裹EH粒子并帮助它们分散。我们使用了三种方法来确认这一过程。第一种方法是EDS。假设在EH表面涂覆含有多个胺基的25kD PEI,表面会有氮存在。EDS结果表明,EH表面未发现氮元素。然而,在pEH的表面发现了氮元素(5.32%)(图4A和B)。第二种方法是测量每个样品超声处理后钙离子浓度的变化。一般来说,羟基磷灰石晶体结构内部有钙离子,外部有磷酸基团。因此,如果EH的磷酸基与PEI的胺基结合在一起,不仅可以覆盖整个EH颗粒,而且超声作用后钙离子也不会释放出来。图4C显示了EH和pEH释放的钙离子浓度的测量结果。两组钙离子释放结果有显著性差异。正如预期的那样,pEH组钙离子释放较少。第三种方法采用傅立叶变换红外光谱(FT-IR),以确认样品的组成(图4D)。与所有样品相比,只有pEH同时具有PO43-−官能团和胺官能团。通过这些实验,我们证实EH被25kD的PEI包覆得很好。
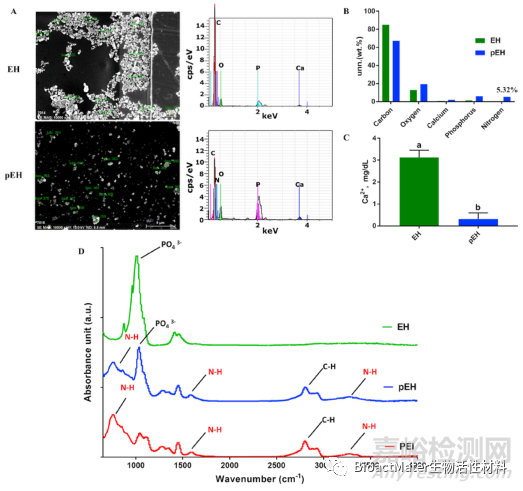
图4 EH和pEH的化学成分分析。(A)EH和pEH的能量色散光谱分析(EDS)结果。(B)EH和pEH中元素含量的分布图。(C)EH和pEH的钙浓度比较。(D)EH、25kD PEI和pEH的FT-IR分析。
当使用阳离子聚合物将基因导入细胞时,适当的载体正电荷对于抓住带负电荷的DNA并穿过带负电荷的细胞壁是很重要的。然后,我们测量了EH和pEH在不同浓度组合下的Zeta电位(图5)。结果正如预期的那样,只有基因和EH带负电荷,而25kD的PEI带正电荷。用25 kD PEI包覆的EH显示出比单独用25 kD PEI更强的正电荷。前者的Zeta电位约为后者的两倍。与基因结合后,pEH的Zeta电位略低,但仍然比25kD的PEI有更高的电位。根据这些结果,我们假设pEH比25kD的PEI具有更多的阳离子支链,这是因为pEH是EH和几种PEI聚合物的复合物,因此可以给它带来更大的电场。我们还想知道,具有比25kD PEI更强的正电荷的pEH是否能够传递基因,或者表现出比25kD PEI更好的性能。
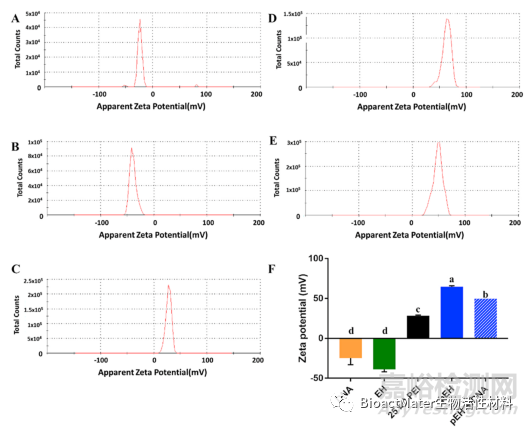
图5 pEH/DNA复合物的物理化学特征。(A)-(E)几种材料的Zeta电位。(A)DNA(2 4.6±8.3 mV);(B)EH(−38.7±3.1 mV);(C)25kD PEI(28.4±0.9 mV);(D)pEH(64.7±1.2 mV);(E)pEH与DNA(49.7±2.5 mV)。(F)Zeta电位的定量分析。
首先,在不同N/P比的琼脂糖凝胶上进行DNA滞留分析,证明pEH能很好地凝聚DNA形成复合物。结果表明,在0.5N/P比下,pEH与DNA形成了很好的复合物,并表明它可以形成比25kD PEI更好的复合物(图6A)。说明pEH的基因载药率高于PEI。
接下来,为了证实pEH的基因转移能力,用荧光素酶分析方法对NIH3t3细胞进行了分析,NIH3t3细胞是一种合适的转染细胞系。令人惊讶的是,与25kD的PEI相比,pEH显示出优异的基因转移能力。在建立了用pEH进行基因传递的条件后,再次在牙髓干细胞(DPSCs)中进行荧光素酶活性测定。结果,在pEH/pGL3处理组中,荧光素酶的表达效率几乎是25kD PEI的两倍(图6B)。
一般来说,根据阳离子聚合物和基因复合物的大小,内吞作用有四种方式(微胞饮作用:≥1μm,依赖于网格蛋白的内吞作用:~200 nm,不依赖于网格蛋白的内吞作用:~90 nm,依赖胞膜窖的内吞作用:~60 nm)。在pEH的情况下,由于其平均大小小于500 nm,预计它将发生在除胞膜窖依赖的内吞作用之外的三种内吞作用途径中。接下来,我们比较了pEH和25kD PEI的细胞毒性(图6C)。转染后25kD PEI处理组比pEH处理组有更强的细胞毒性。这些实验得出了一个有趣的结论。也就是说,与25kD的PEI相比,pEH具有更低的细胞毒性和更好的基因转染能力。
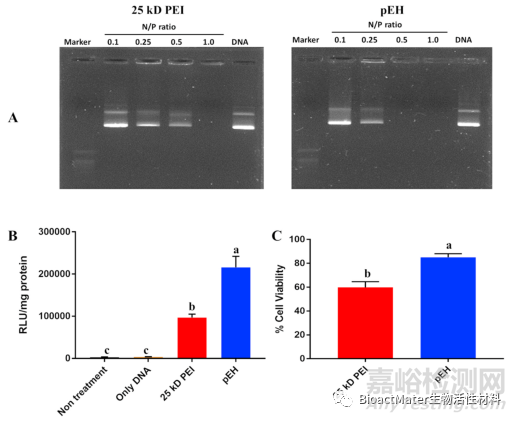
图6 pEH和细胞毒性试验转染结果。(A)凝胶滞留试验。(B)用pEH转染后的荧光素酶检测结果。(C)25kD PEI和pEH处理后的细胞存活率分析。
在验证了pEH作为基因载体后,我们分析了BMP-2基因转染 DPSCs后是否诱导成骨分化。图7A显示了绿色荧光蛋白(GFP)标记的BMP-2质粒/pEH传递后的结果。结果表明,pEH比25kD PEI能更好地将BMP-2基因导入细胞。转染2周后进行茜素红染色分析。BMP-2/pEH处理组的细胞染成最清晰的红色(图7B)。为更准确地确定成骨分化标志物的表达,采用蛋白质印迹法证(Western blot)分析成骨分化标志物的表达。骨桥蛋白(OPN)和骨钙素(OCN)是干细胞分化为骨细胞时表达的主要标志物。矮小相关转录因子2(RUNX2)是一种与成骨细胞分化相关的重要转录因子,其表达受BMP-2调控。令人惊讶的是,在BMP-2/pEH治疗组中,与EH治疗组相比,RUNX2增加了170%以上,OCN增加了160%以上,OPN增加了70%以上。此外,BMP-2/pEH处理组的各表达标记物均显著高于BMP-2/25kD PEI处理组(图7C)。特别是,使用pEH输送BMP-2质粒时,RUNX2的表达量与使用25kD PEI时大约相差4倍。这意味着BMP-2/pEH促进了BMP-2蛋白的表达,从而诱导了RUNX2的表达,并诱导了RUNX2诱导的其他标志物的表达。通过这些结果证实,用pEH将BMP-2基因导入干细胞,可以很好地诱导成骨分化。
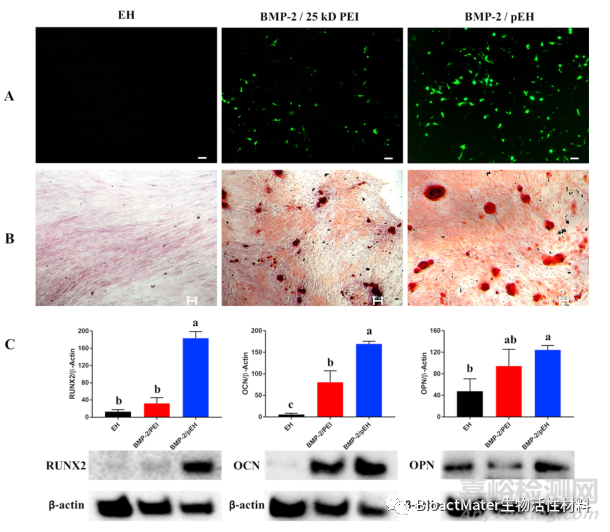
图7使用携带pEH的BMP-2质粒进行成骨分化。(A)用pEH(比例尺=100μm)转染后,绿色荧光蛋白标记的骨形态发生蛋白-2的表达结果。(B)BMP-2/pEH处理2周后茜素红染色结果。(比例尺=100μm)。(C)BMP-2/pEH处理2周后的Western blot结果。
综上所述,我们研制的载体具有回收废弃农副产品的优势。此外,我们希望在利用弃置禽畜废物的新领域进行更积极的应用研究。我们的工作是首次利用马骨来源的改性羟基磷灰石构建基因传递系统,并利用该方法诱导骨分化,这是一项非常创新的研究。我们的团队将尝试使用这种通过DPSCs成功诱导骨分化的系统进行牙齿再生,并计划深入研究新的可再生生物材料的使用。
02论文第一/通讯作者简介
第一作者:Myung Chul Lee
Department of Biosystems & Biomaterials Science and Engineering, Seoul National University, Seoul, 08826, Republic of Korea
通讯作者:Yun-Hoon Choung
Department of Otolaryngology, Ajou University School of Medicine, Suwon, 16499, Republic of Korea
Ajou University Graduate School of Medicine, Bk21 Plus Research Center for Biomedical Sciences, Suwon, 16499, Republic of Korea
通讯作者:Pankaj Garg
Research Institute for Agriculture and Life Sciences, Seoul National University, Seoul, 08826, Republic of Korea
通讯作者:Jong Hoon Chung
Department of Biosystems Engineering, Seoul National University, Seoul, 08826, Republic of Korea
Research Institute for Agriculture and Life Sciences, Seoul National University, Seoul, 08826, Republic of Korea
BK21 Global Smart Farm Educational Research Center, Seoul National University, Seoul, 08826, Republic of Korea
03原文信息
M.C. Lee, H. Seonwoo, K.J. Jang, S. Pandey, J. Lim, S. Park, J.E. Kim, Y.-H. Choung, P. Garg, J.H. Chung,
Development of novel gene carrier using modified nano hydroxyapatite derived from equine bone for osteogenic differentiation of dental pulp stem cells,
Bioactive Materials 6(9) (2021) 2742-2751.
doi: 10.1016/j.bioactmat.2021.01.020

来源:BioactMater生物活性材料


