您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2021-03-26 14:34
鲎,音[hòu],sb(horseshoe crab),属于蛛形纲 [4] (Arachnida)剑尾目(Xiphosura)的海生节肢动物,鲎形似蟹,身体呈青褐色或暗褐色,包被硬质甲壳,有四只眼睛,其中两只是复眼 [1] ,头胸甲前端有0.5毫米的两只小眼睛,对紫外光最敏感,只用来感知亮度,头胸甲两侧有一对大复眼。虽然鲎可以背朝下拍动鳃片以推进身体游泳,但通常将身体弯成弓形,钻入泥中,然后用尾剑和最後一对步足推动身体前进。
鲎的祖先出现在地质历史时期古生代的泥盆纪,当时恐龙尚未出现,原始鱼类刚刚问世,随着时间的推移,与它同时代的动物或者进化、或者灭绝,而惟独只有鲎从4 亿多年前问世至今仍保留其原始而古老的相貌,所以鲎有“活化石”之称。
由于受国家政策影响,内毒素检测试剂所用原料鲎(中国鲎及圆尾鲎)被列为国家二级保护动物(国家林业和草原局、农业农村部2021年2月25日公告(2021年第3号)),意味着内毒素检测试剂原料将受到严格管控,目前药典收录方法都是以鲎试剂为基础制定,新方法只能寄希望于药典委尽快出台配套替代方法。
目前国际上其他新兴的细菌内毒素检测方法:
1、利用重组技术人工合成鲎试剂中的关键酶-C 因子来量化细菌内毒素的重组 C 因子法;
2、仍然使用鲎试剂,但用量仅为原方法的十分之一的微量凝胶法。
法律背景
《中华人民共和国野生动物保护法》第二十七条 禁止出售、购买、利用国家重点保护野生动物及其制品。因科学研究、人工繁育、公众展示展演、文物保护或者其他特殊情况,需要出售、购买、利用国家重点保护野生动物及其制品的,应当经省、自治区、直辖市人民政府野生动物保护主管部门批准,并按照规定取得和使用专用标识,保证可追溯,但国务院对批准机关另有规定的除外。实行国家重点保护野生动物及其制品专用标识的范围和管理办法,由国务院野生动物保护主管部门规定。出售、利用非国家重点保护野生动物的,应当提供狩猎、进出口等合法来源证明。
《中华人民共和国野生动物保护法》第三十三条 运输、携带、寄递国家重点保护野生动物及其制品、本法第二十八条第二款规定的野生动物及其制品出县境的,应当持有或者附有本法第二十一条、第二十五条、第二十七条或者第二十八条规定的许可证、批准文件的副本或者专用标识,以及检疫证明。
第三百四十一条 【非法猎捕、杀害珍贵、濒危野生动物罪】【非法收购、运输、出售珍贵、濒危野生动物、珍贵、濒危野生动物制品罪】非法猎捕、杀害国家重点保护的珍贵、濒危野生动物的,或者非法收购、运输、出售国家重点保护的珍贵、濒危野生动物及其制品的,处五年以下有期徒刑或者拘役,并处罚金;情节严重的,处五年以上十年以下有期徒刑,并处罚金;情节特别严重的,处十年以上有期徒刑,并处罚金或者没收财产。
那么,首先我们来看看为啥要把内毒素检测试剂所用原料鲎(中国鲎及圆尾鲎)被列为国家二级保护动物?
其实也简单,所谓没有利益就没有伤害!
鲎的历史可以追溯至古生代的泥盆纪,那时,恐龙尚未出现,原始鱼类刚刚问世。然而,自从鲎被用来开发检测内毒素之后,世界各地均出现疯狂捕捞过度开采的现象。就我国而言,因索取无度,才20余年我国沿海的鲎已从遍布海滩到几乎绝迹。
内毒素检测的发展史
1912年,Hort和Penfold开发并完善了一种兔子动物模型,该模型促进了注射热的研究。他们对兔子模型精心控制了品种、性别、体重、食物和环境饲养条件。在每个实验中都报告了剂量。间隔30分钟进行温度测量。实验设计使他们能够最终证明,当使用新鲜蒸馏水进行静脉注射时,不存在发烧体(FPB)。Hort和Penfold取消了与以下各项有关的所有理论:(a)水热,(b)盐热,(c)碳水化合物热,(d)发酵热和(e)组织热。不幸的是,直到1923年,他们的工作才得到适当的认可。
1923年,Florence Seibert认可了Hort和Penfold进行科学研究的基本价值。她对注射热的研究使用了他们开发的相同的兔子模型。Seibert成功地确认并扩展了前提条件,即蒸馏水中的热源材料是细菌来源的,并且这些材料不会通过过滤除去。最重要的是,她介绍了“一种制备非热源水的方法”。她的制备非热原性蒸馏水的方法包括用碱将连接塞子加热几次(去热原),并在蒸馏瓶上方引入一个“收集器”。捕集并防止热原被机械地带入馏出物中。
随着1930年代整个肠胃外产业的兴起以及二战之前和二战期间对肠胃外解决方案的大量需求,确保商业肠胃外解决方案不受热原污染的需求触发了美国药典(USP)的发展,热原体药典测试应运而生。1941年,USP、NIH、FDA和14家制药公司合作开展了热原测试的第一项研究。该研究利用了由Hort,Penfold和Siebert开发的兔子模型,合作的结果导致在1942年的USP第12版中包括了第一个药典热原试验。该试验需要静脉注射溶液和一组兔子的直肠温度测量三个小时。
在1964年至1968年期间,Levin和Bang报道革兰氏阴性细菌内毒素具有凝结大西洋马蹄蟹血液的能力。他们确定对血液中细菌内毒素的敏感性(源自革兰氏阴性细菌)是由于其血细胞,变形细胞中的酶。由于测试是基于鲎(血鲎),并且由于所述酶从获得的鲎细胞通过裂解具有高纯度的蒸馏水,试验被评为鲎变形细胞溶解物,或LAL。Levin and Cooper于1971年发表的一篇文章报道说,与RPT相比、LAL(鲎试剂)更灵敏且成本更低。它激发了全世界对于确定BET作为RPT替代品的适用性的兴趣。
1973年,FDA公布了用于生产LAL的拟议生产规范。LAL的制造商必须在使用前向FDA提交每批样品以进行测试。临时使用LAL可使行业获得实际经验。常规上使用创新的LAL测试来测试原材料,过程中的样品,首批(FOB)和批中(MOB)样品。批次结束(EOB)样品需要兔子测试,因为EOB被认为是最坏的情况。
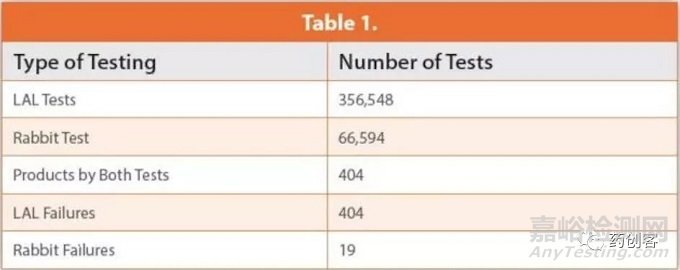
最大的医疗设备和LVP生产商Baxter Travenol认识到LAL测试的简单性和耐用性,于1973年做出了一项公司决定,将LAL验证为其全球设施的内毒素测试。在1979年和1982年,他们报告了其年度内毒素检测结果。这些数据包括66594 USP兔热原测试和356548 LAL测试。值得注意的是,两种方法均测试了404个自然污染的样品。LAL测试确认了内毒素的存在,所有404个样品均未通过测试。但是,按照USP第<151>章热原测试,对所有404个样品进行的八次兔子测试仅导致19次失败。这些数据明确表明,LAL是更灵敏的方法,革兰氏阴性细菌内毒素是对肠胃外产品制造影响最大的热原。这些数据和45年的经验证明了LAL测试的特异性(检测一系列内毒素的能力)。如下表1所示:
内毒素检测的未来:
测量和检测居住在纯净水系统中的微生物群落产生的所有内毒素的能力(Burkholderiaceae,Methylobacteriaceae,Comamonadaceae类/科的成员)对于WFI系统的操作控制绝对必要。目前,LAL测试的重组替代品不能始终如一地做到这一点。必须在重组蛋白质化学或重组制剂方面取得进一步进展。对LAL重组替代品的提炼必须考虑对天然环境内毒素的反应性,而不是高度纯化的脂多糖标准品。药典LAL测试与任何重组替代品之间的差异必须科学解决。与1980年代初期采用LAL测试类似,LAL不是单一酶,LAL不是三种酶,LAL确实包含三种蛋白酶酶原,已知它们与细菌内毒素的顺序激活有关。LAL还包含对β1-3葡聚糖敏感的G因子酶。LAL包含可溶性蛋白质凝结原,可通过活化的凝血酶将其转化为不溶性凝胶。LAL还包含三种丝氨酸蛋白酶抑制剂样蛋白,可调节LAL内毒素和葡聚糖激活级联反应。LAL包含抗LPS因子,可中和细菌内毒素,抗微生物肽,α2-巨球蛋白,大防御素和胱抑素。LAL是鲎450万年原始的免疫系统,和人类鲎将继续作为针对人类和动物注射药物的有效且可靠的安全性测试。我们认识到,人们对大西洋horse的种群可持续性存在担忧。
重组表达的C因子检测方法
幸运的是,能够取代鲎试剂的检测方法已经问世。Lonza科学家开发了PyroGene™重组表达的C因子检测方法。C因子是内毒素激活的鲎凝固级联反应中的第一个组成部分,只用于内毒素检测,是进行内毒素释放测试的可靠替代方案。
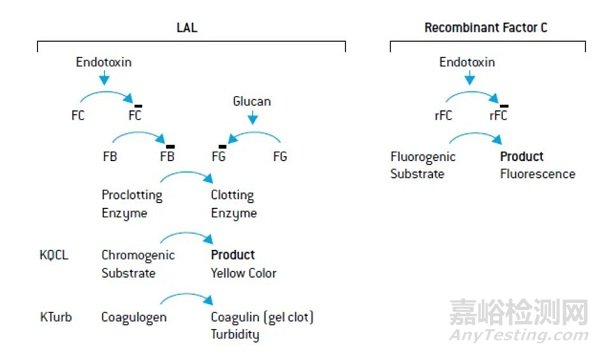
LAL和重组C因子检测的原理示意图
重组C因子是一种化学合成的试剂,性状更稳定,均一性相对也更好。试剂价格目前和鲎试剂相当,后期如在国内外广泛应用起来,价格会比鲎试剂更具竞争优势。
目前,FDA现已批准重组C因子作为鲎试剂的替代方案,用于生物制品的放行和过程检测。2020版中国药典通则9301附录里面也有关于重组C因子的检测说明,但是如需放行检测,还需要做相关验证试验。
内毒素检测只是生物制剂质量控制的冰山一角,然而这一角冰山却足以毁灭一个物种。正如更多更好的药物可以造福更多的人,对环境更友善的检测方法也能造福更多的“小鲎小虾”。

来源:GMP办公室、蒲公英制药论


