您当前的位置:检测资讯 > 法规标准
嘉峪检测网 2020-02-27 17:31
作者:王琰,张培培 1, 姚尚辰 1, 尹利辉 1, 林兰 , 张彦民 2, 胡昌勤 1
1. 中国食品药品检定研究院, 北京 102629;
2. 西安交通大学药学院, 西安 710061
摘要:
目的: 药品中外源性残留蛋白不仅影响药品质量,且严重威胁人用药安全。青霉素G酰基转移酶(简称PGA)是酶法工艺生产β-内酰胺抗生素过程中所用关键催化酶,有必要对其进行研究并严格控制终产品中的蛋白残留量。已有方法采用凝胶过滤法(GFC)对残留蛋白进行前处理,但该法存在富集效率低等诸多问题。本文探讨并尝试建立一种不同方式和原理的蛋白分离、富集方法,采用超滤前处理结合考马斯亮蓝(Bradford)法测定酶法工艺产品阿莫西林中残留蛋白的含量。方法: 采用Amicon®Ultra-15型超滤管(15 mL,截留分子量为3 kDa)对阿莫西林供试液进行前处理,离心力为5000 g(7000rpm),对溶液进行净化并对蛋白进行浓缩富集,再采用Bradford法对浓缩液进行蛋白定量测定,检测波长为595 nm。结果: 该法具有较好的专属性;蛋白浓度在1.0~100.0 μg·mL-1(r=0.9921)内校正曲线(lg A~lg C)的线性关系良好;回收率>72%(n=3×3);Bradford法最低检出限为0.1 μg·mL-1,相当于0.0001%;Bradford法的精密度≤ 5.0%。结论: 该方法准确、可靠,相比于已有方法,蛋白富集量更大、操作简便、设备要求低,可用于酶法工艺阿莫西林中残留蛋白的测定,对酶法工艺半合成抗生素中残留蛋白的质控及酶法工艺稳定性监测提供了一定技术指导。
关键词:超滤 Bradford法 酶法工艺 阿莫西林 残留蛋白 含量测定
阿莫西林(AMO)是一种β-内酰胺类半合成抗生素(图 1), 具有高效广谱抗菌作用, 通过抑制细菌细胞壁黏肽合成酶的活性而使细菌丧失活性[1]。临床中主要用于治疗革兰氏阳性杆菌和阴性杆菌所致各种感染, 如胃炎、慢性支气管炎及尿路感染等[2]。阿莫西林的生产一直采用经典化学法, 但该法反应步骤多、有机试剂用量大、会产生大量的工业"三废", 造成严重环境污染。酶法工艺是一种较新发展起来的绿色生物催化技术, 具有反应步骤少、反应选择性高和工业"三废"产生少等优点, 2000年后国际上开始大规模应用于β-内酰胺抗生素的商业化生产[3-4]。青霉素G酰基转移酶(简称PGA)是该工艺中用到的关键催化酶, 在这种催化酶的催化作用下, 起始原料6-氨基青霉烷酸(6- APA)可与D-对羟基苯甘氨酸甲酯(D-HPGM)通过催化反应直接合成阿莫西林。
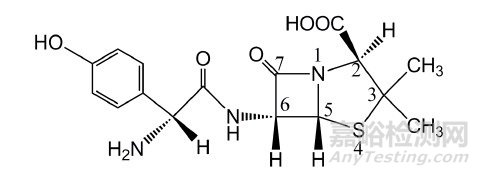
图 1 阿莫西林结构式
帝斯曼制药公司(英文名称DSM)最早开始研究酶法工艺技术并用于阿莫西林的工业化大生产。目前, 国内已有多个企业逐渐采用酶法工艺生产阿莫西林原料。由于该工艺中用到的PGA是一种生物大分子, 已有文献研究结果表明[5-6], 大分子外源性蛋白可引起诸多不良反应, 与药品安全性密切相关。另一方面, 我国企业的该类产品在经CDE审评或出口欧盟时, 质控机构要求提供残留蛋白检测数据, 以证明酶法工艺的可靠性[7-9]。因此, 从药品质控角度和法规要求两方面考虑, 均有必要严格监控终产品中PGA残留量。
目前, 相关法规仅要求注册申报时应提供相关检测数据, 但未对相关检测方法提出明确要求。对于酶法工艺合成阿莫西林, 终产品中残留蛋白除来自PGA外, 还可能来自于起始原料6-APA合成上游发酵工艺中的宿主蛋白及发酵液等。当较难获得PGA及相关标准品的情况下, 可采用测定总蛋白方法对终产品中的残留蛋白的总量进行控制。目前, 有多种蛋白定量检测方法, 如考马斯亮蓝(Bradford)法、福林酚(Lowry)法、凝胶过滤(GFC)法、质谱法等[10-11]。相比于其它方法, Bradford法线性范围较宽, 灵敏度更高, 适用于低浓度蛋白的测定, 是一种通用、快速简便的检测方法[12-13]。但是, 由于阿莫西林结构中含有多个氨基结构, 实验考察结果表明氨基会对Bradford法产生干扰, 表现为溶液颜色变蓝, 不能直接测定, 因此, 需要对阿莫西林与残留蛋白进行分离前处理。目前对抗生素中残留蛋白进行前处理的方法如GFC法[14], 虽能对残留蛋白进行有效分离与富集, 但对仪器设备要求高、分离效果受凝胶色谱柱填料影响大、需多次进样收集, 实验周期长, 大大影响了实验效率。超滤技术是介于微滤和纳滤之间的一种膜分离技术, 具有分离、浓缩和净化等作用, 其截留机理主要包括膜筛分和静电作用[15]。不同于GFC法, 超滤法根据不同截留分子量(MWCO)滤膜对残留蛋白进行富集, 具有操作更简便、仪器要求更低等优点[16-18]。本研究依据阿莫西林(分子量为365.4)和蛋白分子(如PGA是由一个异质二聚体构成, 总分子量约8万[19])之间分子量的较大差异, 尝试采用超滤法对抗生素样品进行前处理, 目的是将供试品溶液中阿莫西林干扰去除、净化溶液(降低溶液盐浓度)和对样品中的微量蛋白进行浓缩富集。实验通过考察不同超滤步骤及准确性确定最优超滤条件, 对阿莫西林原料中残留总蛋白进行有效分离和富集, 然后采用Bradford法对蛋白进行准确定量。
1 仪器与试药
AmiconⓇ Ultra-15型超滤管(15 mL, MWCO为3 kDa, 德国Merk Millipore公司), AllegraTM 64R型高速低温离心机(美国Beckman Coulter公司), Thermo酶标仪(美国Thermo公司), CP225D型电子分析天平(德国Satorious公司)和Milli-Q Reference型高纯水发生仪(德国Merk Millipore公司); 96孔板(美国Corning公司); 20、100、200和1000 μL移液器(德国Eppendorf公司)。
牛血清白蛋白(BSA)标准品(批号TK269567, 2 mg·mL-1, 美国Thermo公司); 阿莫西林(6批, 市售); 蛋白染料Bradford试剂(批号033K9279, 美国Sigma公司); 碳酸钠为分析纯; 水为Milli-Q超纯水。
2 方法与结果
2.1 溶液配制
2.1.1 标准品贮备液(Ⅰ)
精密量取BSA标准品适量, 加水溶解并稀释成浓度为100 µg·mL-1的溶液。
2.1.2 标准品贮备液(Ⅱ)
精密量取BSA标准品适量, 加0.04%碳酸钠(Na2CO3)溶液溶解并稀释成浓度为100 µg·mL-1的溶液。
2.1.3 标准溶液
精密量取标准品贮备液(Ⅰ)适量, 分别加水溶解并稀释成浓度为0.4、2.0和20.0 µg·mL-1的溶液, 作为标准溶液(Ⅰ)、(Ⅱ)和(Ⅲ)。
2.1.4 供试品溶液
精密称取阿莫西林1.0 g, 加4% Na2CO3溶解并稀释成浓度为100 mg·mL-1的溶液, 待用。
2.1.5 4% Na2CO3溶液
精密称取4 g Na2CO3, 加水100 mL溶解并稀释, 即得。
2.1.6 0.04% Na2CO3溶液
精密量取4% Na2CO3溶液适量, 按1:100比例加水稀释, 即得。
2.2 样品前处理
精密量取待用溶液5 mL置超滤管, 按图 2中路线1或路线2方法进行前处理, 采用5000 g(7000 rpm)离心力超滤, 最终浓缩得上层溶液约1 mL, 待测。
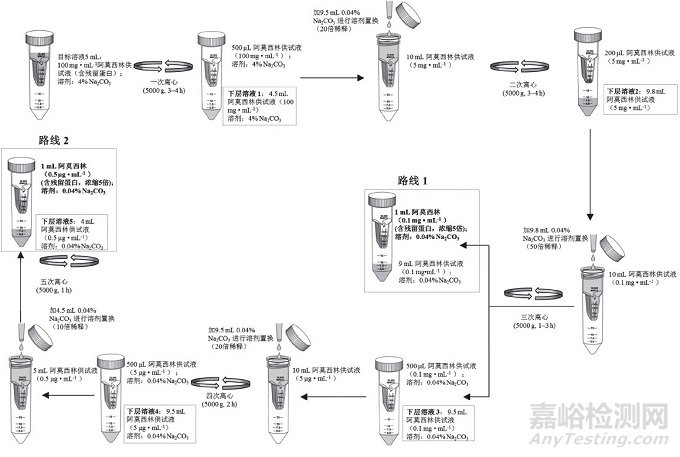
图 2 样品前处理流程图(路线1和路线2)
2.3 测定法
精密量取待测溶液500 μL, 加入500 μL的Bradford试剂, 混匀, 在室温下放置5 min, 吸取该溶液150 μL置96孔板中, 于595 nm的波长下测定其吸光度值。
2.4 专属性
Bradford蛋白定量法原理为考马斯亮蓝G-250染料与蛋白质的芳香族氨基酸和/或碱性氨基酸结合, 溶液由红色变成蓝色, 于595 nm下测定其吸光度, 进而通过吸光度与已知蛋白质浓度关系测定未知蛋白质的含量[10-11]。由于阿莫西林结构中6位侧链含有两个碱性氨基(伯氨和仲氨), 会对Bradford法测定产生干扰, 实验发现, 阿莫西林可使考马斯亮蓝染料明显变蓝, 因此, 采用超滤法对样品进行前处理以除去阿莫西林。实验采用AmiconⓇ Ultra-15型超滤管, MWCO为3 kDa, 即超滤时分子量大于3 kDa的大分子均被截留至上层液, 而分子量小于3 kDa的小分子均透过超滤膜被离心至下层液。阿莫西林分子量约为365 Da, 如果考虑其溶液状态下可能形成二聚体甚至三聚体, 其分子量不会超过3 kDa。因此, 样品溶液超滤前处理时, 阿莫西林及其聚合物会被较好地去除, 上层液中仅保留分子量在3 kDa以上的大分子蛋白, 用于进行后续蛋白专属测定。
2.5 线性与范围
精密量取标准品贮备液(Ⅱ)适量置1.5 mL小管, 分别加0.04% Na2CO3溶液稀释至500 μL, 制成蛋白浓度分别为1.0、5.0、10.0、25.0、50.0和100.0 µg·mL-1的溶液。按"2.3"节下方法测定吸光度值, 以lg A(吸光度值的对数)为纵坐标, lg C (浓度的对数)为横坐标, 绘制标准曲线并得回归方程。结果显示, 回归方程为lg A=0.6940 lg C- 1.6259, 回归系数r为0.9921。表明该方法的蛋白浓度在1.0~100.0 µg·mL-1, 线性关系良好。
2.6 精密度
精密量取"2.5"节下浓度分别为1.0、5.0、10.0、25.0、50.0和100.0 µg·mL-1蛋白系列溶液各3份置96孔板, 按"2.3"节下方法测定吸光度值, 计算相对标准偏差(RSD)。结果显示RSD≤2.3% (n=6×3), 表明该方法重复性良好。取上述蛋白系列溶液同法连续3天进行测定, 结果显示RSD≤5.0%(n=6×3×3), 表明该方法重现性良好。
2.7 检测限
以0.04% Na 2CO3溶液作空白, 取样3份, 按"2.3"节下方法连续测定吸光度值, 得均值(Ā)和标准差(SD), 分别以Ā+3SD和Ā+10SD为考察指标, 计算该法的LOD和LOQ。该法的LOD为0.1 µg·mL-1, 代入公式1计算即为0.0001%(相当于1 ppm); LOQ为0.6 µg·mL-1, 即0.0003%(相当于3 ppm)。表明该法的灵敏度良好。
公式1:

2.8 准确度
精密量取标准品贮备液(Ⅰ)适量置1.5 mL小管, 分别采用水和4% Na2CO3溶液做溶剂, 稀释制成蛋白浓度水平分别为0.2、1.0和10.0 µg·mL-1的溶液, 待用; 再分别精密量取供试品溶液各2.5 mL, 分别加标准溶液(Ⅰ)、(Ⅱ)和(Ⅲ)各2.5 mL, 混匀, 制成蛋白浓度水平分别为0.2、1.0和10.0 µg·mL-1的加样回收溶液, 待用。分别精密量取上述制备得到的待用溶液各5 mL, 按"2.2"节下方法中路线1进行前处理(图 2中路线1), 再采用"2.3"节下方法进行测定, 得到吸光度值, 由"2.5"节下蛋白标准曲线得到相应浓度并计算回收率。结果显示, BSA在3种溶液中的回收率均大于72%(见表 1), 表明回收率良好。
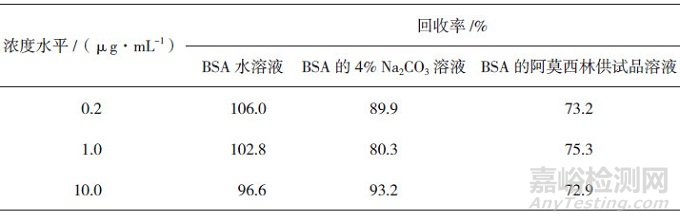
表 1 BSA在3种不同溶液中回收率考察结果
2.9 样品测定
精密量取供试液5 mL, 分别按"2.2"节下方法中路线1和路线2进行前处理, 再精密量取200 μL上层溶液, 加0.04% Na2CO3溶液300 μL混匀, 按"2.3"节下方法进行测定, 得吸光度值(A), 由"2.5"节下蛋白标准曲线得到相应蛋白浓度(C), 将该值代入公式1计算样品中残留蛋白的量, 结果见表 2。
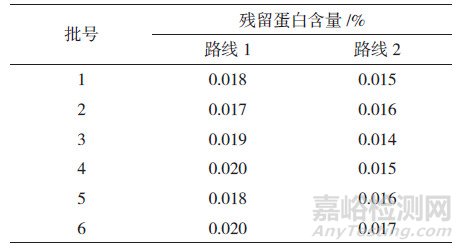
表 2 采用2种样品前处理方式测定得到的阿莫西林中残留蛋白含量
3 讨论
3.1 样品超滤前处理条件摸索与考察
由于样品中残留蛋白含量低, 为增加检出效率, 实验尽可能配制高浓度供试品溶液。由于阿莫西林原料为阿莫西林酸的形式, 无法溶于水, 根据生产工艺并结合实验考察, 采用4% Na2CO3溶液作为溶剂可较好地溶解阿莫西林酸制备高浓度供试液。但高浓度阿莫西林(100 µg·mL-1)和4% Na2CO3均会明显使Bradford试剂变蓝, 干扰测定。因此, 实验采用超滤法对样品中残留蛋白进行浓缩富集并对溶液进行脱盐置换。
实验考察了不同浓度的阿莫西林供试液和不同浓度的Na2CO3溶液对Bradford试剂的影响。分别对100 mg·mL-1阿莫西林供试液和4% Na2CO3溶液按10倍比的稀释因子(1:10、1:102、1:103、1:104和1:105)逐级进行稀释, 然后按"2.3"节下方法测定各溶液吸光度, 同时以水作为空白进行对比。结果显示, 起始溶液100 mg·mL-1阿莫西林供试液和4% Na2CO3溶液会导致Bradford试剂明显变蓝(A>0.5), 随着2种溶液不断稀释, 溶液浓度不断降低, 其对Bradford试剂的影响均逐渐下降。当4% Na2CO3溶液稀释10倍(0.4%, 图 3A虚线所示)、阿莫西林供试液稀释103倍(此时溶液中阿莫西林浓度为0.1 mg·mL-1, Na2CO3浓度为0.004%, 图 3B虚线所示)时, 两者的吸光度值几乎与水相当, 认为已无干扰。上述实验结果可以看出, 阿莫西林对Bradford试剂的影响要明显大于Na2CO3溶液对Bradford试剂的影响, 是超滤前处理步骤设计中应考虑的主要影响因素。
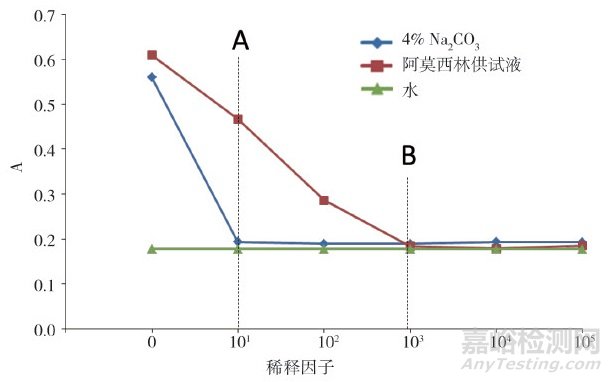
图 3 4% Na2CO3溶液和阿莫西林供试液不同稀释因子吸光度曲线图
以此实验结果为依据, 设计超滤前处理步骤, 离心力采用5000 g(超滤管推荐最大离心力), 稀释剂选择0.04% Na2CO3溶液(超滤管推荐Na2CO3溶液浓度应≤20%), 取阿莫西林供试液5 mL置超滤管, 依次进行离心和溶液稀释置换处理, 具体见图 2中路线1。当进行3次离心超滤后, 供试液中阿莫西林浓度降至0.1 mg·mL-1, 同时溶剂基本置换为0.04% Na2CO3, 两者均对后续Bradford法测定不产生干扰, 而此时溶液中残留蛋白的含量浓缩了5倍(相当于富集500 mg阿莫西林中残留蛋白的量)。因此, 实验采用路线1作为供试液超滤前处理方法。
3.2 超滤前处理法的准确性与应用探讨
实验通过对不同BSA溶液的回收率考察超滤膜的截留效率。结果显示, 对BSA水溶液进行单次离心超滤, 回收率>96%;当进行3次离心超滤, 回收率>90%, 表明超滤膜对BSA水溶液的截留效率较高。考虑碱液和抗生素可能对超滤膜材质产生影响, 进而降低截留效率, 实验进一步考察发现, 当采用4% Na2CO3溶液作为溶剂配制BSA溶液时, BSA回收率降低至80%~90%;而BSA在阿莫西林供试液中的加样回收实验结果显示, 回收率进一步降低为70%~80%, 提示Na2CO3和阿莫西林会对超滤膜材质产生影响, 在一定范围内降低其对大分子物质的截留效率, 离心步骤(次数)越多, 会导致回收率偏低, 影响超滤提取的准确性。
为进一步考察上述实际影响, 实验在采用路线1对样品进行前处理的基础上, 增加了超滤前处理步骤, 还采用图 2中路线2同时平行对6批样品的供试液进行超滤前处理, 然后分别收集5次离心步骤所得的下层溶液(图 2中下层溶液1~5), 按"2.3"节下方法测定各溶液吸光度值, 结果显示, 随着超滤不断进行, 下层溶液的吸光度曲线不断降低, 当经过第三次离心超滤前处理后(图 4A虚线所示), 下层溶液3的吸光度值基本与空白稀释剂(0.04% Na2CO3)的吸光度值一致; 随着超滤进一步进行, 后续步骤下层溶液4和5的吸光度曲线与空白稀释剂吸光度曲线基本平行(图 4), 提示当超滤完成3次离心处理后, 已能达到溶液净化、蛋白浓缩的目的。对2种路线样品超滤前处理后最终所得上层待测液进行测定, 结果显示, 路线1测得样品中残留蛋白的含量略高于路线2, 表明超滤步骤过多会使样品中蛋白富集产生一定损失, 影响超滤前处理的准确性。因此, 实验最终采用路线1 (图 2)作为超滤前处理条件, 既保证了测定准确性, 又提高了实验效率。
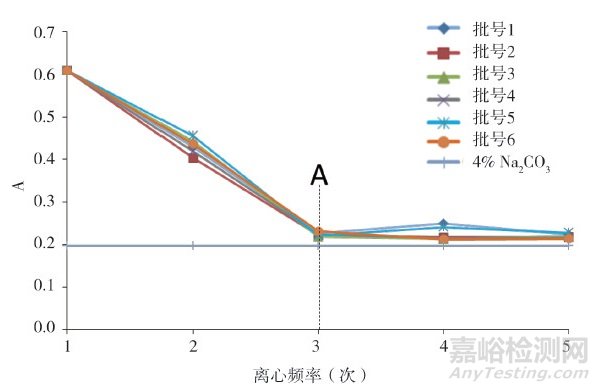
图 4 6批阿莫西林供试液离心下层液吸光度曲线图
相比较于其它前处理方法(如GFC法), 超滤法具有对仪器要求低、操作简便、浓缩富集量大等优点。对于GFC法, 当对200 mg样品中的残留蛋白进行富集时, 需要进样4次(60 min·次-1·批-1, 上样量500 µL), 而超滤法一次处理即可同时实现对6批供试品中相当于500 mg样品中的残留蛋白量进行富集, 大大提高了实验效率。此外, 超滤法得到的浓缩液可直接用于测定, 无需经冻干、复溶等步骤处理, 且残留蛋白不经过液态-固态-液态的形式转变, 不对蛋白自身结构产生影响。但值得注意的是, 目前市售商品化超滤管基本为水溶性滤膜, 对含有机溶剂(或有机相比例较高)的溶液不耐受, 因此, 超滤法仅适用于水溶性样品中残留蛋白的富集。
参考文献
[1] 陈立平. 浅析西药阿莫西林的药理作用机制以及临床应用[J]. 中国卫生标准管理, 2016, 7(18): 83-84.
[2] 再曼, 王虎. 西药阿莫西林的药理作用机制以及临床应用[J]. 世界最新医学信息文摘, 2015, 15(81): 112-113. DOI:10.3969/j.issn.1671-3141.2015.81.084
[3] Bruggink A, Roos E C, De Vroom E. Penicillin Acylase in the Industrial Production of β-lactam Antibiotics[J]. Org Process Res Dev, 1998, 2(2): 128-133. DOI:10.1021/op9700643
[4] Moellering R C. Past, Present and Future of Antimicrobial Agents[J]. Am J Med, 1995, 99(6): 11-18. DOI:10.1016/S0002-9343(99)80279-4
[5] Schnyder B, Brockow K. Pathogenesis of Drug AllergyCurrent Concepts and Recent Insights[J]. Clin Exp Allergy, 2015, 45(9): 1376-1383. DOI:10.1111/cea.12591
[6] 胡昌勤. 抗菌药中高分子杂质的特性及抗菌药过敏反应(上)[J]. 中国药师, 2006, 9(3): 238-240. DOI:10.3969/j.issn.1008-049X.2006.03.020
[7] European Medicines Agency (EMA). Guideline on Setting Specifications for Related Impurities in Antibiotics[EB/OL]. London: EMA, 2012[2019-08-11]. http://www.ema.europa.eu/ema/index.jsp?curl=pages/regulation/general/general_content_000736.jsp&mid=WC0b01ac0580028e8c. http://en.cnki.com.cn/CJFD_en_New/Detail.ashx?t=e&url=/Article_en/CJFDTOTAL-YWPJ201102030.htm
[8] European Medicines Agency (EMA). Guideline on Summary of Requirements for Active Substances in the Quality Part of the Dossier[EB/OL]. London: EMA, 2005[2019-08-11]. https://www.ema.europa.eu/documents/scientific-guideline/guideline-summary-requirements-active-substancesquality-part-dossier-revision-1_en.pdf.
[9] Products of Fermentation[S]//European Pharmacopoeia: 9th Edition, 2017: 830-831.
[10] 周跃男, 王湛, 赵小川, 等. 浅谈蛋白质的定量检测方法[J]. 食品研究与开发, 2014, 4(35): 127-130.
[11] Total Protein[S]//European Pharmacopoeia: 9th Edition, 2017: 172-175.
[12] Bradford M M. A Rapid and Sensitive Method for the Quantitation of Microgram Quantities of Protein Utilizing the Principle of Protein-dye Binding[J]. Anal Biochem, 1976, 72(1-2): 248-254. DOI:10.1016/0003-2697(76)90527-3
[13] Chutipongtanate S, Watcharatanyatip K, Homvises T, et al. Systematic Comparisons of Various Spectrophotometric and Colorimetric Methods to Measure Concentrations of Protein, Peptide and Amino Acid:Detectable Limits, Linear Dynamic Ranges, Interferences, Practicality and Unit Costs[J]. Talanta, 2012, 98: 123-129. DOI:10.1016/j.talanta.2012.06.058
[14] Xu M Z, Ma S H, Hu C Q. Gel Filtration Chromatography Combined with Bradford Method for Determination of Total Residual Protein in Ferment Antibiotics[J]. J Chin Pharm Sci, 2004, 13(4): 262-266.
[15] 詹丽娜, 陈沁, 古淑青, 等. 超高效液相色谱-四极杆/静电场轨道阱高分辨质谱检测食品中的牛奶过敏原酪蛋白[J]. 色谱, 2017, 35(4): 405-412.
[16] 徐陈凤, 惠文凯, 孙莉莉, 等. 基于超滤离心前处理的液相色谱-串联质谱法手性拆分人血浆中的亚叶酸和5-甲基四氢叶酸非对映异构体及其药代动力学应用[J]. 色谱, 2019, 6(37): 581-588.
[17] 鞠玲燕, 宋晓华, 谷婕, 等. 超滤管净化/高效液相色谱-串联质谱法测定动物源食品中喹诺酮类药物残留[J]. 分析测试学报, 2016, 35(1): 42-47. DOI:10.3969/j.issn.1004-4957.2016.01.007
[18] 许丽珠, 李秀英, 黄金凤, 等. 超滤离心净化-高效液相色谱法同时测定配方乳粉中的单糖、双糖和低聚果糖[J]. 食品安全质量检测学报, 2015, 6(2): 633-638.
[19] Duggleby H J, Tolley S P, Hill C P, et al. Penicillin Acylase Ihas a Single-amino-acid Catalytic Centre[J]. Nature, 1995, 373(6511): 264-268. DOI:10.1038/373264a0

来源:xml-data


