《中国药典》第11 版——2020 年版的编制工作已进入收官阶段。本文围绕《中国药典》2020年版编制大纲的指导思想、目标及各部的最新编制进展进行介绍,并归纳了2020 年版的7 个主要特点。
伴随着中国经济和社会的快速发展以及医药产业的不断进步,《中国药典》编制工作也取得了很大的进展及成就。《中国药典》从1953 年版到现在共历经了10 版, 1963 年版增加了一部——中药标准部分;2005 年版增加了三部——生物制品标准;2015 年版增加了四部——主要收载通用性技术要求(通则和指导原则)及药用辅料标准。目前,2020 年版编制工作已接近尾声,现将编制的最新进展情况简要介绍如下:
一、编制大纲的指导思想
《中国药典》2020 年版编制大纲始终贯彻了两个重要指导思想:
一是创新、协调、绿色、共享、开放五大发展理念。创新,包括体制机制创新、管理理念方式创新、检测技术方法创新。协调,是指既要关注国内与国际标准的协调,也要关注《中国药典》与局颁标准、注册标准的协调或国家标准与社团标准、企业标准的协调。绿色,是指要倡导绿色环保和人文关怀,即尽量采用节约资源、保护环境、简便实用的检测方法,尽量减少毒性高、污染大的溶剂或试剂以及实验动物的使用。开放,是编制药典一直坚持的工作方针。要突出政府在国家标准制定中的主导作用和企业在产品标准制定中的主体地位。同时,采取积极的鼓励政策和措施引导社会和行业将更多的人力、物力、财力投入标准制修订,构建标准形成机制的新格局。共享,是指要强化标准作为公共产品服务行业和社会的功能,为促进标准信息共享,需要以更多形式投入到市场,除了纸质版本之外,今后将陆续推出电子版本。
二是建立“最严谨的标准”。习近平总书记在2015 年5 月29 日中央政治局第23 次集体学习时强调指出,要切实加强食品药品安全监管,用最严谨的标准、最严格的监管、最严厉的处罚、最严肃的问责,加快建立科学完善的食品药品安全治理体系。“四个最严”重要论述将“最严谨的标准”放在首位,凸显了标准对于药品质量及其监管的重要性。建立“最严谨的标准”,是贯彻落实“四个最严”的基础,包括标准的建立过程要严谨、研究方法要严谨、规定限度要严谨以及执行标准要严谨。
二、编制大纲的目标
(一)总体目标
《中国药典》2020 年版编制大纲的总体目标包括两个方面:一是管理目标方面,要完善《中国药典》标准体系建设,提升《中国药典》标准整体水平。标准制定更加严谨,品种遴选更加合理,与国际标准更加协调,标准形成机制更加科学。二是品种目标方面,实现中药标准继续主导国际标准制定;化学药品、药用辅料标准基本达到或接近国际标准水平;生物制品标准从过去的跟跑、并跑,到一些领域的领跑,紧跟科技发展前沿,与国际先进水平基本保持一致。
(二)具体目标
1.适度增加品种的收载,进一步满足临床需要
品种的遴选原则:①坚持“临床常用、疗效确切、使用安全、工艺成熟、质量可控”。②全面覆盖国家基本药物目录、国家基本医疗保险用药目录,适应临床治疗用药指南调整变化的需要。③重点增加原料药、中药材、药用辅料标准的收载和新制剂的收载,要充分体现我国医药创新成果。
2. 结合国家药品标准清理,逐步完善药品标准淘汰机制
在提高完善的同时,要注重对历史性标准的梳理,并全面清理国家已有药品标准。加大对已经取消文号、长期不生产、质量不可控、剂型不合理、稳定性不高的药品标准的淘汰力度。对于需要开展临床价值或风险效益评价的品种,提请相关部门进行评价。
3. 健全《中国药典》标准体系,强化药品质量全程管理的理念
要加强药品标准体系的建设,特别是要落实药品质量全程管理的理念,这跟《药品管理法》的修订也是相契合的。横向来看,需进一步提高覆盖中药、化学药品、生物制品、原料药、药用辅料、药包材以及标准物质的质量控制技术要求;纵向来看,需进一步完善涵盖《中国药典》凡例、制剂通则、总论、检验方法以及指导原则的制定和修订。此外,还需逐步加强和完善涉及药品研发、生产、流通和使用等环节的通用性技术要求和指导原则体系建设,体现药品质量源于设计,有赖于全过程控制保障的理念。
4. 规范《中国药典》标准结构
规范标准结构包括:①进一步完善《中国药典》标准各部间的统一协调及内容规范。②建立统一规范的药品通用名称命名规范(包括中药、化学药品、生物制品、药用辅料以及药包材)。③研究制定药品标准编码体系,制定《中国药典》名词术语目录,规范药典用语。
5. 加强标准的交流与合作,促进国际间药典的协调统一
《中国药典》的编制采取对外开放的态度,拟与WHO 和各国药典机构合作共同建立药典交换机制和多国药典对比信息平台,为推进国际间药典标准协调奠定技术基础。以药品进出口贸易需求为导向开展标准协调工作。通过加强双边和多边的国际交流与合作,突出中药标准的国际主导地位,不断扩大《中国药典》和中国药品质量的国际影响力。
三、编制工作最新进展
一部(中药)编制进展
1. 标准增修订的总体情况
《中国药典》2020 年版中药材、中药饮片共拟修订药材标准218 个(不含重金属、禁用农药涉及的数量);重金属、禁用农药通用要求涉及药典收载的植物类药材标准有544 个;植物油脂和提取物拟修订7 个;中成药拟新增加品种117 个,修订品种160 个。
2. 围绕安全性方面的增修订情况
(1)有效控制外源性污染物对中药安全性造成的影响,全面制定中药材、饮片重金属及有害元素、农药残留的限量标准。例如:①建立和完善安全性检测方法,全面制定中药材与饮片中重金属及有害元素、农药残留的限量标准,并收入相应通则项下。铅不得过5mg/kg,镉不得过1mg/kg,砷不得过2mg/kg,汞不得过0.2mg/kg,铜不得过20mg/kg ;禁用农药不得检出。②修订通则2341农药残留量测定法,增订药材及饮片(植物类)中禁用农药的残留测定法。③修订通则9302 中药中有害残留物限量制定指导原则。
(2)全面制定易霉变中药材、饮片真菌毒素限量标准。例如:①蜂房、土鳖虫等4 个增加了黄曲霉毒素的限量要求。②薏苡仁增加玉米赤霉烯酮的限量要求。
(3)有效控制内源性有毒成分对中药安全性产生的影响,重点解决符合中药特点的肝肾毒性预测及评价方法。例如:①九味羌活丸中肾毒性成分“马兜铃酸”的限量标准研究。②补骨脂中补骨脂二氢黄酮的限量标准研究。③附子中乌头碱的限量标准研究。
3. 围绕有效性方面的增修订情况
(1)强化中药标准的专属性和整体性,不断创新和完善中药分析检验方法。例如:①穿心莲。一标多测法同时测定4 个主要成分。②银杏叶提取物。供试品指纹图谱中应呈现17 个与对照提取物指纹图谱相对应的色谱峰。③冠脉宁胶囊。建立了一个液相色谱条件同时测定丹参中的丹酚酸B和葛根中的葛根素的含量测定方法。
(2)重点开展基于中医临床疗效的生物评价和测定方法研究。例如:①金银花。特征图谱项目中增加环烯醚萜苷类成分控制,现代药理研究证明环烯醚萜苷类成分具有保肝利胆、抗炎镇痛、解热、抗病毒等作用,契合金银花在中医临床中“清热解毒”的功效。②地黄、熟地黄。药理学试验表明地黄苷D 具有滋阴、补血及降血糖活性,其药效作用亦与中医临床传统用药相符合,故增加地黄苷D作为熟地黄饮片的含量测定指标,删去毛蕊花糖苷的指标,即诠释体现了中医临床功效,又体现了中药传统炮制特色。③女贞子、酒女贞子。女贞子炮制后女贞苷转化为红景天苷,前者含量指标为特女贞苷,后者修订为红景天苷。
二部(化学药品)编制进展
1.标准增修订的总体情况
拟新增品种共125 个,修订品种113 个。拟不收载品种:①转三部品种5 个(重组人胰岛素、重组人胰岛素注射液、精蛋白重组人胰岛素注射液、重组人生长激素、注射用重组人生长激素)。②国家药监局已撤销文号停止生产的2 个品种。③经药学遴选拟不收载的1 个品种(复方氢氧化铝片,因标准中缺少颠茄流浸膏的质量控制项)。
2. 围绕安全性方面的增修订情况
(1)进一步完善杂质和有关物质的分析方法,推广先进检测技术的应用,强化对有毒有害杂质的控制。例如:①青蒿素。杂质I 乘以校正因子不得过0.15%,相对保留时间约为0.10 处的杂质不得过2.0% ;其他单个杂质峰面积不得过0.3%,总杂质限度不得过2.5%。②酮咯酸氨丁三醇和酮咯酸氨丁三醇注射液。规定了3 个已知杂质,杂质Ⅰ乘以校正因子不得过0.5%,杂质Ⅱ和杂质Ⅲ乘以校正因子不得过0.1% ;其他单个未知杂质采用主成分自身对照法,限度收紧为0.1%,总杂质收紧为1.0%。
(2)加强对药品安全性相关控制项目和限度标准的研究制定。例如:①丙泊酚乳状注射液、脂肪乳注射液(C14-24)中乳粒。a. 采用粒度和粒度分布测定法(四部通则0982);b. 关于单位粒子光学传感技术的光阻法(对大于5μm 乳粒进行限量控制)。②磺酸盐类和沙坦类药物中增加“生产要求”项目。③供口服用的生化药的原料标准中增订【制法要求】项。具体品种包括胰酶、胰激肽原酶、甲状腺粉、胃蛋白酶等。
3. 围绕有效性方面的增修订情况
(1)将药品一致性评价的成果体现在提高相关制剂的质量标准,完善药品临床有效与质控项目的设置以及控制要求的相关性,提高药品的质量可控性。
(2)进一步完善常规固体制剂溶出及释放度检测方法。例如,铝碳酸镁咀嚼片——质酸力的研究:标准中采用溶出度第三法装置,参考BP质酸力项,10 分钟和20 分钟时,溶液的pH 应在3.0~4.2 范围内。并将质酸力滴定终点由指示剂法(溴酚蓝指示液)修订为pH 指示法(滴定至pH3.5)。克霉唑阴道膨胀栓、硝酸益康唑阴道膨胀栓增加膨胀率检查。
(3)在整体质量控制方面,进一步借鉴国际要求,逐步与国际要求保持一致。例如,头孢唑肟钠参考《日本药典》(JP16)将含量限度范围由“不得少于90.0%”修订为“应为92.5%~96.5%”。
三部(生物制品)编制进展
1. 增修订总体情况
品种各论:新增品种标准22 个,修订品种标准140 个。总论:新增总论4 个,修订总论4 个。生物制品通则技术要求:新增2 个,修订8 个。通则(检测方法和指南):新增14 个,修订4 个。
2. 具体情况
(1)进一步完善生物制品全过程质量控制的要求。例如:①对人用狂犬病疫苗残余DNA 和HCP 限度标准进行了重新评估和修订。②人和动物来源血液制品:进一步提升病毒安全性、杂质控制要求。③治疗性重组蛋白制品:完善重组细胞因子类产品的杂质控制要求。
(2)进一步补充完善生物检测技术、方法以及相关技术指南;推动理论分析方法在生物制品质量控制中的应用。例如,研究建立完成国际上首个PEG 修饰重组蛋白药物总论、新增基因治疗产品总论、螨变应原制品总论、人用马免疫血清制品总论。
(3)完善品种收载类别,建立治疗性生物制品的相关通用技术要求;加快对我国近年来批准上市的、成熟的疫苗及治疗性生物药的收载。例如:①新增涉及全球公共卫生安全问题且需求量不断增大的预防性疫苗如:脊灰疫苗(bOPV、IPV)和肺炎疫苗。②新增首个自主创新用于眼底黄斑病变的抗血管内皮生长因子受体抗体融合蛋白(康柏西普)。
四部(通则辅料包材)编制进展
1. 制剂通则部分
制剂通则修订36 个;增订相关检测方法15 个;新增指导原则9 个;修订完善检测方法30 个、指导原则11 个。
(1)进一步完善和提高制剂通则的要求。例如,①修订0100 制剂通则。为了进一步引导企业全面关注制剂生产质量控制和整体要求,增加并充实了《制剂通则》的前言部分内容作为“各制剂需关注的兜底条款”,主要包括6 个方面:单位剂量均匀性、稳定性、安全性与有效性、剂型与给药途径、包装与贮藏、标签与说明书。②修订[0101片剂、0103 胶囊剂、0104 颗粒剂、0105 眼用制剂、0106 鼻用制剂、0107 栓剂、0108 丸剂、0109 软膏剂 乳膏剂、0112 喷雾剂、0114凝胶剂、0115 散剂、0117 搽剂、0118 涂剂、0119 涂膜剂、0120 酊剂、0123 口服溶液剂 口服混悬剂 口服乳剂、0124 植入剂、0125 膜剂、0126 耳用制剂、0127 洗剂、0128 冲洗剂、0129 灌肠剂、0181 合剂、0182 锭剂、0183煎膏剂(膏滋)、0188 茶剂]。③修订(0102 注射剂、0111 吸入制剂、0113 气雾剂、0116 糖浆剂、0120 贴剂、0121 贴膏剂、0184 胶剂、0185 酒剂、0187 露剂)。
(2)增加国内上市药品成熟的新剂型的收载。例如,栓剂中增加膨胀栓。
2. 通用检测方法和指导原则部分
(1)紧跟国际药典标准趋势,进一步扩大先进成熟检测技术的应用,提高检验方法的专属性、灵敏度和可靠性。例如:①增订堆密度与振实密度测定法;肝素生物测定法新增抗Ⅱ a 因子、抗Ⅹ a因子测定法;硫酸鱼精蛋白效价测定法新增肝素结合力滴定法;修订组胺类物质检查法、降压物质检查法。②增订X 射线荧光光谱法、固体密度测定法。③增订聚合酶链式反应法、比表面积测定法、细菌DNA 特征序列鉴定法;相对密度测定法新增振荡型密度计法;修订微生物计数法、细菌内毒素检查法、残留溶剂测定法等。
(2)体现仿制药质量和疗效一致性评价的成果转化。例如, 溶出度测定法新增流池法和往复筒法。
(3)加强对中药材外源污染控制方法和限度指标的制定。例如:①修订农药残留量测定法。②增订5 种真菌毒素(黄曲霉毒素、赭曲霉毒素A、玉米赤霉烯酮、呕吐毒素、展青霉素)和多种真菌毒素测定法;修订非无菌药品微生物限度标准。③增订中药饮片微生物限度检查法。
(4)完善灭菌工艺验证、环境检测等相关技术要求的制定。例如,修订灭菌法。
(5)建立药典检测技术平台,进一步将检测技术系统化。例如:①建立分子生物学检测技术药典标准体系平台。正在搭建。②增订标准核酸序列建立指导原则、DAN 测序技术指导原则。③增订细菌DAN 特征序列鉴定法。④增订聚合酶链式反应法。
(6)强化检验方法适用性要求制定,以保证药典检测方法在不同生产企业的适用性和检测结果的可靠性。例如:①修订生物检定统计法。②修订分析方法验证指导原则。③增订分析方法转移指导原则、分析方法确认指导原则。
(7)加强生产过程控制技术指南制定。例如:①注射剂安全性检查法应用指导原则增订了单核细胞活化反应测定法。②修订药品洁净实验室微生物监测和控制指导原则。③增订灭菌用生物指示剂指导原则、生物指示剂耐受性检查法指导原则;修订无菌检查用隔离系统验证指导原则。
(8)提高《中国药典》与国际通用性技术的统一性。例如:①修订原料药物与制剂稳定性试验指导原则。②增订遗传毒性杂质控制指导原则、元素杂质限度和测定指导原则。③修订缓释、控释和迟释制剂指导原则。
(9)加快制定检测技术指导方法,注重先进检测技术储备,实现检测方法先行。例如:①增订DAN 测序技术指导原则。②增订细菌内毒素检查法应用指导原则。③修订药品微生物实验室质量管理指导原则、微生物鉴定指导原则。
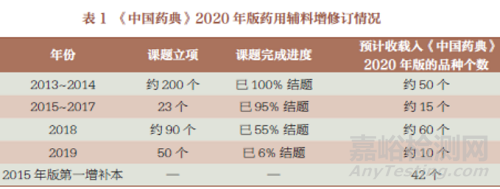
3. 药用辅料品种各论部分
《中国药典》2020 年版拟增订药用辅料品种约50 个,修订120 个。具体增修订情况见表1。
4. 药用辅料通用技术要求部分
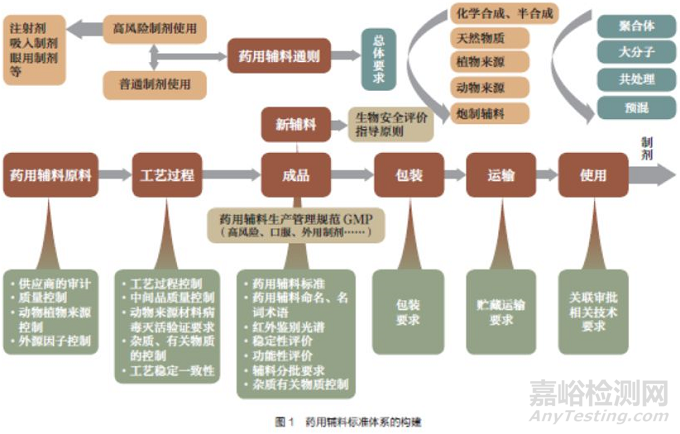
(1)注重《中国药典》四部凡例、通则0251药用辅料与各论标准的衔接。如将凡例中不属于检定要求的药用辅料监管内容调整到通则中,将不适于在各论中分别规定的关于无菌的内容统一在通则中规定。
(2)中国药用辅料通用名称命名原则已基本成型。将随着药用辅料及其标准研究的深入而不断更新,但不收载入《中国药典》。
(3)《中国药典》2020 年版涉及药用辅料的通用技术要求预计包括4 个:通则0251 药用辅料(修订)、9601 药用辅料功能性相关指标指导原则(修订)、动物源药用辅料指导原则(新增)、预混与共处理药用辅料指导原则(新增)。
(4)拟制修订的药用辅料标准有以下特点:①常用辅料、新型辅料、高风险/ 高风险制剂用辅料数量显著增加。②标准描述更精准,如稀盐酸、玉米朊、活性炭。③增加专属性更强的鉴别,如果胶。④选用更客观的检测方法,如丁烷。⑤增加功能性相关指标,如白陶土、硬脂酸。⑥增加安全性指标,如玉米油。⑦增加产品内在质量区分度,如十二烷基硫酸钠。⑧增加特殊用途的特殊要求,如磷酸二氢钾。⑨规范性状(溶解度、味、臭)、无菌、微生物限度、细菌内毒素等在各论中的描述。
药用辅料标准体系的构建见图1。
5. 药包材品种各论部分
①《中国药典》2020 年版大纲要求药包材品种收载30 个。② 2015~2019 年度共立项品种类课题36 个(2015 年10 个,2016 年25 个,2017 年1 个)。目前已经提交草案的有12 个,结题4 个。③药用辅料及药包材专业委员会2019 年第一次会议专家意见:考虑到药包材药典标准现状,品种类课题暂不予纳入《中国药典》,待药包材药典框架完善后一并考虑。
6. 药包材通用技术要求部分
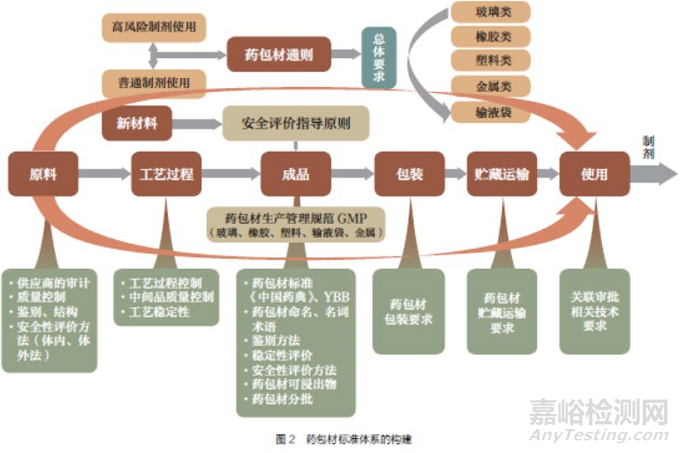
(1)直接接触药品的包装系统与组件命名原则已基本成型。将随着药包材研究的深入而不断更新,但不收载入《中国药典》。
(2)涉及药包材的通用技术要求拟收载4 个:①药包材通则(在药包材通用要求指导原则基础上修订)。②药用玻璃材料和容器通则(在药用玻璃材料和容器指导原则基础上修订)。③药用塑料材料和容器通则(新增)。④药用橡胶密封件通则(新增)。
(3)通用检测方法拟收载18 个:三氧化二硼测定法;内表面耐水性测定法;玻璃内应力测定法;121℃玻璃颗粒耐水性测定法;剥离强度测定法;热合强度测定法;拉伸性能测定法;气体透过量测定法;水蒸气透过量测定法;密度测定法;包装材料红外光谱测定法;透光率测定法;溶血检查法;热原检查法;细胞毒性检查法;急性全身毒性检查法;注射剂用胶塞、垫片穿刺力测定法;注射剂用胶塞、垫片穿刺落屑测定法。
药包材标准体系的构建见图2 。
四、主要特点
综上所述,《中国药典》2020 年版可归纳以下七个主要特点:①药典标准体系进一步完善。②药品质量控制水平不断提高。③新技术新方法的应用。④全过程质量控制体系逐步构建。⑤标准形式机制不断完善。⑥与关联审评审批制度改革相适应。⑦标准与国际接轨。