您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2024-04-23 09:17
2021年3月,世界卫生组织发布了首份《世界听力报告》[1],听力损失影响全球超过15亿人,约占全球人数的五分之一。目前我国有听力语言障碍的残疾人2057万,耳聋在新生儿中的发病率为1‰~3.47‰,遗传因素致聋比例达50%~60%[2,3]。60%的重度耳聋与遗传有关,另外40%可能与环境因素有关。在遗传性耳聋中,根据是否伴有多个系统病变又分为综合征型耳聋与非综合征型耳聋。遗传性耳聋的遗传方式主要有四种,常染色体显性遗传(15%~20%)、常染色体隐性遗传(约80%)、性连锁(1%)及线粒体遗传性耳聋(1%)[3]。遗传性耳聋具有较强的基因异质性。中国人群中最常见的致聋基因有GJB2、SLC26A4,其中GJB2基因235delC突变是中国耳聋患者中发生频率最高的突变形式,有18.26%的耳聋患者携带此突变;其次是SLC26A4基因c.919-2A>G突变是中国大前庭水管患者群的热点突变,15.23%的耳聋患者携带此突变,74.8%的大前庭水管患者携带此突变[4-6]。
1. 国内相关产品的注册情况
采用分子生物学方法检测遗传性耳聋相关基因突变对于耳聋患者的遗传学诊断以及早期干预和治疗至关重要[7-9]。随着耳聋相关基因的研究进展以及检测技术的发展,申报产品从最初的单个基因单突变位点检测逐渐到多基因多突变位点的检测。申报产品所采用的方法学多种多样,如荧光PCR方法、荧光PCR熔解曲线法、PCR-反向点杂交法,以及微阵列芯片法、联合探针锚定聚合测序法、飞行时间质谱法等。
截至2023年6月,已批准的遗传性耳聋相关基因检测试剂共11个,检测的基因位点已覆盖四个基因的20余个突变位点(表1),样本类型包括静脉全血和干血斑。目前所批准的检测试剂的预期用途均为“用于遗传性耳聋的辅助诊断”。
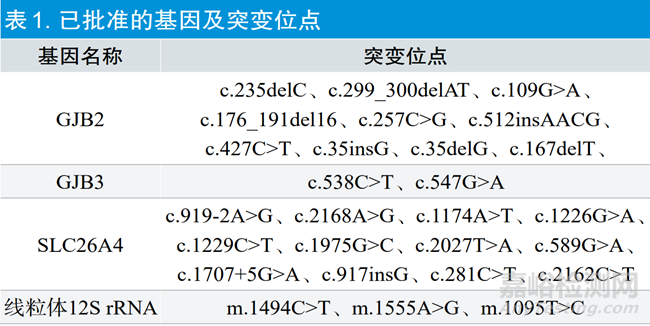
近年来遗传性耳聋相关基因的检测产品所申报的突变位点逐渐增多,后续还会有更多的涉及新位点检测产品的申报。对于境内未有已批准同类产品的新基因变异的临床证据应如何认可,是此类产品技术审评中的疑难问题之一。另外我国已批准的遗传性耳聋相关基因的检测产品的预期用途均为遗传性耳聋的辅助诊断。针对新生儿耳聋基因筛查,临床上陆续有《遗传性耳聋基因变异筛查技术专家共识》[4]《遗传性耳聋筛查规范》[2]对外发布,全国较多城市启动新生儿遗传性耳聋基因筛查。在临床上针对新生儿进行听力与耳聋基因的联合筛查,可作为常规物理听力筛查的补充,特别是可发现常规物理听力筛查无法检出的药物性致聋基因携带者和迟发性耳聋基因携带者,从而进行早期干预和指导等[10-14]。目前已有申报新生儿筛查用途的检测试剂已完成临床试验并进入注册申报。
2. 临床试验设计的关注点
针对此类试剂的注册现状以及申请人在注册申报中所面临的难点,国家药品监督管理局医疗器械技术审评中心在2020年启动了指导原则的编写工作,经过企业调研、邀请行业内权威专家的研讨、征求生产企业的意见等流程,于2021年该指导原则已对外发布,旨在给申请人在注册申报过程中提供技术指导[15]。以下针对指导原则中对该类试剂在临床试验开展过程中应重点关注的问题逐一进行阐述。
2.1 预期用途的声称
目前,遗传性耳聋相关基因突变检测在遗传性耳聋的辅助诊断以及新生儿遗传性耳聋基因突变筛查等领域有重要意义。例如通过对具有耳聋症状和/或体征的人群,以及其他需要进行耳聋基因突变检测的人群,如有耳聋家族史的人群等进行耳聋基因突变的检测可用于遗传性耳聋的辅助诊断;对新生儿进行遗传性耳聋基因突变筛查,可作为常规物理听力筛查的补充,特别是可发现常规物理听力筛查无法检出的药物性致聋基因携带者和迟发性耳聋基因携带者,从而进行早期干预和指导等。新生儿耳聋基因筛查联合听力筛查,可以有效提前遗传性耳聋患儿的干预时间。新生儿遗传性耳聋基因突变筛查用途的应用应符合国家及地方卫生管理部门的相关规定。申请人应根据申报产品所声称的预期用途,分别设计临床试验进行验证。应重点关注不同的预期用途,入组人群应不同,临床试验设计亦不同。以下针对上述的两个预期用途的临床试验设计做重点阐述。
2.2 临床试验入组人群
对于预期用途为遗传性耳聋的辅助诊断的检测试剂,入组人群应为具有耳聋症状和/或体征人群以及有耳聋家族史的人群。临床试验中不建议入组健康体检人群或孕前检查人群等,不正确的入组人群会导致入组人群的偏倚,无法正确地评价试验体外诊断试剂的临床性能。
对于预期用途为新生儿遗传性耳聋基因突变的筛查的检测试剂,入组人群则应为新生儿。临床设计应采用前瞻性入组病例的形式开展临床试验。
2.3 临床试验机构的选择
遗传性耳聋相关基因突变检测试剂属于体外诊断试剂三类产品,按照法规要求,应选择至少三家经医疗器械临床试验备案的临床试验机构开展临床试验[16]。
对于开展新生儿耳聋基因筛查临床试验的临床机构,临床试验机构具有相关资质,应是各地卫生健康部门指定的进行新生儿耳聋基因筛查的临床机构。建议选择不同地区的临床试验机构开展临床试验,且临床试验机构应具有遗传性耳聋的诊疗能力、常规开展遗传性耳聋相关基因的检测。操作人员应经过相应的培训,并能熟练操作实验。
2.4 临床试验设计
临床试验设计与申报产品所声称的预期用途息息相关,预期用途不同,所采用的临床试验设计亦应不同。以下分别针对预期用途为“遗传性耳聋辅助诊断”“新生儿耳聋基因筛查”的检测试剂的临床试验设计进行详细阐述。
2.4.1预期用途为“遗传性耳聋辅助诊断”
对于有同类产品的申报产品,临床试验中可选择与已上市同类产品进行比较研究的方式。选择已上市同类产品作为对比试剂时应充分考虑其预期用途、方法学、样本类型、所检测的基因位点、分析性能等方面应与申报产品具有良好的可比性。而对于尚无同类产品的申报产品,临床试验中应选择参考方法(如一代测序法)进行比较研究。此部分临床试验可以回顾性富集入组临床样本,但不应入组临床试验机构留存的核酸。
对于申报产品中包含新基因位点的产品,除了与参考方法进行比较研究外,还应针对新位点的临床意义提供临床证据。如新突变位点的临床意义已获行业认可(如:国内相关指南或专家共识),且上述认可基于充分的中国人群的临床研究数据,提交相关的指南或专家共识即可。
如新突变位点未获行业认可,申请人首先应提供该基因新突变位点与耳聋表型相关的遗传学证据,包括但不限于:耳聋患者和正常人群的等位基因突变频率、耳聋患者家系共分离、生物信息学分析、权威数据库的信息等基于中国人群的充分的研究数据,对基因突变和表型的关系进行评估,新突变位点应具有明确致病性。申请人应注意,针对新突变位点的家系研究,应符合该突变位点家系内基因型与听力表型共分离,并不要求在临床试验中开展该研究,可以是发表的文献、研究成果等[17]。临床试验中也应纳入新突变位点阳性的病例,应分析基因型与临床表型的相关性,可通过随访或其他临床验证资料来证明。建议同时对所检出携带新突变位点的耳聋患者进行家系分析。
2.4.2预期用途为“新生儿耳聋基因筛查”
针对此预期用途的临床试验应包括两部分,筛查用途的确认和临床检测准确性的评价。
筛查用途的确认应前瞻性入组新生儿,申报试剂对所有入组受试者进行检测,病例基因变异状态采用临床参考标准(如:一代测序法)进行确认,评价申报试剂的临床性能。对于听力筛查异常的新生儿,应进行进一步的听力检查以确认其听力状态以及基因突变状态以避免申报试剂的假阴性。同时对先天性耳聋的新生儿应提供病例的临床诊断结果,临床诊断结果应有充分的依据,如采用现有条件下公认的、可靠的、权威的疾病诊断标准,疾病诊疗指南中明确的疾病诊断方法,行业内的专家共识等。对于申报产品检测出的遗传性耳聋相关基因纯合突变或复合杂合突变的新生儿,应通过随访最终确认该患儿的听力状态,以避免申报产品检测的假阳性。
对于临床检测性能的评价,申请人还应同时选择已批准上市、临床普遍认为质量较好的同类产品或参考方法作为对比试剂,与申报试剂进行一定例数的比较研究试验,以评价申报试剂的临床准确性。此部分验证位点应涵盖申报产品的所有突变位点。此部分研究可使用部分已确诊(回顾性)的阳性病例进行研究。应在试验方案和报告中对病例选择的方式和原因进行明确的说明。
应注意,申请新生儿遗传性耳聋基因筛查预期用途的申报产品,其检测的基因及突变位点,均应为已得到行业内公认的、与遗传性耳聋具有明确致病性关系的基因位点。并且对于筛查试剂,应结合基因突变位点在中国人群的携带频率考虑筛查的卫生经济学考虑,不建议将携带频率较低的突变位点纳入新生儿筛查的检测试剂的检测范围内。
2.5 临床试验样本量
适宜的样本量是保证临床试验能够充分评价试验体外诊断试剂的关键性因素。建议采用单组目标值法进行样本量的估算,应根据阳性符合率、阴性符合率分别进行最低阳性样本量及阴性样本量的估算。对于常见的基因位点,总阳性样本量、总阴性样本量应满足上述最低样本量的要求。同时对于临床中较为常见的纯合突变,如GJB2的c.235delC、SLC26A4的c.919-2A>G能够,临床试验中应纳入一定例数。
对于在中国人群中携带率较低、临床中较为罕见的突变位点,为了能够在一定程度上评价试验体外诊断试剂对于此类突变位点的临床检测性能,临床试验中也应纳入一定的例数,每种突变位点不少于5例。按照卫健委2019年发布的《罕见病诊疗指南》[18],遗传性耳聋相关基因突变所导致的非综合征性耳聋属于罕见病,因此按照国家药品监督管理局发布的《用于罕见病防治医疗器械注册审查指导原则》[19]的相关规定,此类检测试剂可以附条件上市,对于在临床试验中纳入病例较少的罕见位点,申请人可以上市后进一步完成相关临床验证工作。
对预期用途为新生儿耳聋基因筛查的申报试剂,根据临床发病率、临床诊治情况及其他因素综合考虑,通过统计学方法估算最低阳性样本量以及总样本量。对于我国相对常见的遗传性耳聋突变位点,如GJB2的c.235delC、c.299_300delAT、c.176-191del16,SLC26A4的c.919-2A>G、c.2168A>G、线粒体DNA 12S rRNA的m.1555A>G突变等,应通过前瞻性临床试验检出突变病例,总例数应满足统计学要求;其他人群突变率相对更低的突变位点也应尽可能在前瞻性临床试验中检出。
2.6 样本类型
一般来说,用于遗传性耳聋的辅助诊断,一般为抗凝外周血样本类型;用于新生儿耳聋基因筛查的一般为干血斑样本类型。对于同时声称抗凝外周血和干血斑两种样本类型的申报试剂,鉴于两种样本类型在样本基质、核酸总量等方面存在较大差异,在临床试验中应分别估算样本量,分别进行临床评价。新生儿干血斑样本的采集应符合卫健委发布的《新生儿疾病筛查技术规范》的相关要求。
2.7统计分析
以四格表分别总结申报试剂与对比试剂/方法的定性检测结果,计算阳性符合率、阴性符合率、总符合率及其相应的95%置信区间。除总体统计外,还要针对每一个突变位点进行统计分析,同时纯合突变以及杂合突变(或均质突变和异质突变)应分别进行统计分析,以评价申报试剂与对比试剂/方法检测结果的一致性。
对于与对比试剂/方法检测不一致的样本,应结合临床诊断背景信息、第三方检测试剂等综合进行分析。
3. 小结
随着遗传性耳聋基因相关研究的深入,越来越多的新基因和新位点被发现并被用于遗传性耳聋的检测。申请人在设计开发产品时,应注意作为应用于临床的体外诊断试剂,并非检测试剂所包括的基因及位点越多越好,而是应关注纳入的基因位点是否有充分的遗传学证据的支持。尤其在应用于新生儿耳聋基因的筛查中,应考虑社会经济学因素,严格按照卫健委相关部门的政策执行。
参考文献
[1] World Health Organization. World Report On Hearing[R].2021.
[2] 中国耳聋基因筛查与诊断临床多中心研究协作组,全国防聋治聋技术指导组.遗传性耳聋基因筛查规范[J].中华医学杂志,2021,101(2):97-102.
[3] 戴朴, 袁永一.耳聋基因诊断与遗传咨询[M].北京:人民卫生出版社,2017:38-39.
[4] 《遗传性耳聋基因变异筛查技术专家共识》专家组,国家卫生健康委员会临床检验中心产前筛查与诊断实验室室间质评专家委员会,国家卫生健康委员会临床检验中心新生儿遗传代谢病筛查实验室室间质评专家委员会.遗传性耳聋基因变异筛查技术专家共识[J].中华医学遗传学杂志,2019,36(3):195-198.
[5] 马小玲,潘丽华,刘倩,等.遗传性耳聋基因研究进展[J].中国现代医生,2021,59(5):189-192.
[6] 刘亚兰,汪俊程,邓宇元,等.荧光PCR法在非综合征型遗传性耳聋基因诊断中的应用研究[J].中国耳鼻咽喉颅底外科杂志,2016,22(5):345-352.
[7] 刘畅,黄演林,汪安石,等.阶梯式耳聋基因诊断策略及其临床实践[J].分子诊断与治疗杂志,2022,14(1):6-9.
[8] 张昊昱,张宁,张华等.耳聋基因检测在遗传性耳聋诊断及遗传咨询中的应用[J].中华耳科学杂志,2016,14(15):639-643.
[9] 陈文强,熊怡.遗传性耳聋基因筛查对迟发性耳聋的预防作用分析[J].中国医学创新,2018,15(3):120-122.
[10] 阮宇,文铖,赵雪雷,等.75649例新生儿耳聋基因筛查及确诊者随访结果分析[J].中华耳科学杂志,2019,17(55):6661-669.
[11] Dai P, Huang LH, Wang GJ, etal. Concurrent hearing and genetic screening of 180,469 neonates with follow-up in Beijing, China[J]. Am J Hum Genet,2019,105(4):803-812.
[12] 高儒真,樊悦,杨腾裕,等.北京协和医院新生儿耳聋基因筛查10年数据分析[J].协和医学杂志,2022,13(6):1020-1027.
[13] 刘宏彦,刘慧坤,冷俊宏.天津市新生儿听力及耳聋基因联合筛查结果分析[J].临床儿科杂志,2023,41(2):146-149.
[14] 逯铭,杨舒涵,裴圆芳.河南省52120例听力筛查异常新生儿常见遗传性耳聋突变现状分析[J].华南预防医学,2022,48(9):1126-1132.
[15] 国家药品监督管理局.遗传性耳聋相关基因突变检测试剂注册技术审查指导原则[EB/OL].2021-01-19.
[16] 国家药品监督管理局.体外诊断试剂临床试验技术指导原则[EB/OL].2021-09-27.
[17] 余奉徽,王思霁,代佳秋,等.WFS1基因突变致一个遗传性耳聋家系的临床表型及基因型分析[J].中国听力语言康复科学杂志,2021,19(3):164-167.
[18] 国家卫生健康委员会.罕见病诊疗指南(2019版)[EB/OL].2019-02-27.
[19] 国家药品监督管理局.用于罕见病防治医疗器械注册审查指导原则[EB/OL].2018-10-18.
【文章来源】中国医疗器械信息 审评与监管

来源:Internet


