今日头条
科伦广谱抗耐药新药获快速通道资格。科伦药业第二代选择性RET抑制剂A400(EP0031,KL590586)获FDA授予的快速通道资格,用于治疗RET融合阳性非小细胞肺癌(NSCLC)。A400对常见的RET基因融合和突变具有广泛活性,具有克服第一代选择性RET抑制剂耐药的潜力。去年11月,该新药已获得FDA授予治疗RET融合阳性实体瘤的孤儿药资格。值得一提的是,科伦博泰已将该产品在欧美等区域的权益独家授权给Ellipses公司。
国内药讯
1.恒瑞JAK1抑制剂湿疹Ⅲ期临床成功。恒瑞医药JAK1抑制剂艾玛昔替尼(SHR0302)在AAD2024年会上公布了用于治疗中重度特应性皮炎(AD)的Ⅲ期临床长期结果。该项试验在第16周时已达到共同主要终点。52周数据显示,SHR0302(4mg和8mg)治疗患者的研究者总体评估(IGA)应答率(42.3%和40.2%)与湿疹面积和严重度指数改善75%应答率(EASI-75,60.6%和55.9%)持续保持;患者WI-NRS应答率也维持稳定(59.6%和45.1%)。此外,16周-52周期间,未出现新的安全信号。
2.和黄妇科肿瘤新药拟纳入优先审评。和黄医药VEGFR抑制剂呋喹替尼胶囊与信达生物PD-1抑制剂信迪利单抗构成的组合方案,获CDE拟纳入优先审评,用于既往系统性抗肿瘤治疗后疾病进展且不适合进行根治性手术治疗或根治性放疗的晚期pMMR或non MSI-H子宫内膜癌患者。去年7月,这一组合用于治疗既往至少一线含铂治疗失败的pMMR晚期子宫内膜癌患者已被CDE纳入突破性治疗品种。
3.华东GLP-1R/GIPR激动剂获批IND。华东医药旗下杭州中美华东1类化药HDM1005注射液获国家药监局临床许可,拟开发用于2型糖尿病和超重或肥胖人群体重管理。HDM1005是一款GLP-1R/GIPR双靶点激动剂,可通过激活GLP-1受体和GIP受体,促进胰岛素释放,抑制食欲,具有降糖和减重的潜力。临床前研究数据也显示,HDM1005具有良好的成药性和安全性。
4.先声中美双报三抗获批临床。先声药业自主研发的GPRC5D/BCMA/CD3三特异性抗体SIM0500获FDA临床许可,即将在美国开展用于治疗复发或难治性多发性骨髓瘤的新药研究。在临床前研究中,SIM0500已显示出比GPRC5D/CD3双抗以及BCMA/CD3双抗有更好的肿瘤杀伤效果,可潜在克服现有治疗手段所导致的耐药。今年1月,该新药的临床试验申请已获得CDE受理。
5.上海健信两款双抗获批临床。健信生物自主研发的核心产品注射用重组抗PD1/TIM3人源化双特异抗体(Bis5,LB1410)和注射用LB4330(Bis2)的联合治疗方案获国家药监局临床默示许可,拟开展用于治疗晚期/转移性实体瘤的Ib/II期临床试验。这两款新药均已完成单药I期临床爬坡研究,正在进行多种肿瘤疗效扩展研究。Bis2是一款靶向肿瘤CD8+T细胞和CLDN18.2的双功能免疫治疗产品。
6.捷思英达引进肿瘤抑制剂获批IND。捷思英达1类化药Aurora A抑制剂VIC-1911片获国家药监局临床默示许可,将开展VIC-1911单药/联合奥拉帕利治疗晚期乳腺癌的临床研究。VIC-1911最初由日本Taiho公司开发(TAS-119),捷思英达美国子公司VITRAC拥有该药在肿瘤领域的全球独家权益。在美国,VIC-1911已处于I/II期开发阶段,并已被证明没有明显的骨髓抑制毒副作用。
国际药讯
1.首款奥马珠单抗生物类似药报产。Celltrion USA公司奥马珠单抗生物类似药CT-P39已向FDA提交上市申请(BLA),作为Xolair(奥马珠单抗)的可互换生物类似药,用于治疗哮喘、慢性鼻-鼻窦炎伴鼻息肉(CRSwNP)、IgE介导的食物过敏(仅限美国)和慢性自发性荨麻疹(CSU)。在国际III期CT-P39 3.1研究中,与Xolair相比,CT-P39组患者的每周瘙痒严重程度评分(ISS7)较于基线变化的疗效相当(-9.21 vs. -9.98)。
2.强生引进银屑病口服多肽长期疗效积极。强生与Protagonist公司开发的IL-23R拮抗多肽JNJ-2113治疗中重度斑块状银屑病(PsO)的Ⅱb期临床扩展研究FRONTIER 2结果积极。数据显示,JNJ-2113治疗组的缓解率从第16周维持到第52周,其中JNJ-2113(每天两次100mg)队列保持PASI 75应答的患者比例达到76.2%(第16周为78.6%)。临床中未发现新的安全性信号。目前,JNJ-2113也在Ⅱb期ANTHEM-UC研究中评估治疗中重度活动性溃疡性结肠炎的潜力。
3.礼来创新单抗湿疹Ⅲ期临床积极。礼来IL-13抑制剂lebrikizumab治疗中重度特应性皮炎的Ⅲ期试验达到主要终点。第16周时,lebrikizumab治疗实现湿疹面积和严重程度指数相对基线降低75%(EASI-75)的患者比例达到68%;有56%患者的瘙痒数字评定量表[PNRS]的评分改善≥4分。研究中,没有观察到新的安全信号与严重的不良事件,详细结果将在医学会议上公布。
4.银屑病关节炎拮抗剂Ⅱb/Ⅲ期临床积极。ACELYRIN公司IL-17A融合蛋白拮抗剂izokibep治疗银屑病关节炎(PsA)的国际Ⅱb/Ⅲ期临床达到复合主要终点。第16周时,izokibep(160mg Q2W、160mg QW)治疗患者达成美国风湿病学会(ACR)50应答标准的比例显著高于安慰剂(43%和40%,vs15%);达成银屑病面积与严重程度指数(PASI)改善100%(PASI100)的患者比例也更高(47%和51%,vs12%)。此外,izokibep耐受性良好,与已知研究结果一致。
5.Incyte公司痒疹性结节新药Ⅱ期临床成功。Incyte公司口服JAK1抑制剂povorcitinib治疗痒疹性结节(PN)的Ⅱ期临床达到主要和次要终点。与安慰剂相比,povorcitinib(15mg、45mg和75mg)治疗患者第16周时瘙痒数字评估量表(NRS4)评分改善≥4点的比例更高(36.1%、44.4%和54.1%,vs8.1%);达到研究者总体评估治疗成功(IGA-TS)得分为0或1,且从基线起改善≥2级的患者比例更多(13.9%、30.6%和48.6%,vs5.4%)。Povorcitinib总体耐受性良好。
6.MoonLake公司纳米抗体Ⅱ期临床积极。MoonLake公司靶向IL17A/F三特异性纳米抗体sonelokimab治疗银屑病关节炎(PsA)的Ⅱ期临床ARGO达到主要终点。第24周时,sonelokimab治疗达成美国风湿病学会(ACR)50应答的患者比例超过60%,有40%的患者达到ACR70应答;达到ACR50+PASI 90标准的患者比例高达59%,ACR50+PASI 100高达52%,ACR70+PASI 100高达48%。Sonelokimab由三个抗体重链可变区蛋白域共价连接而成。
医药热点
1.中疾控原主任高福加盟浙大。根据浙江大学公开资料显示,中国疾病预防控制中心原主任高福院士已出任浙江大学大健康学院院长。3月14日,高福院士将于浙江大学大健康学院为本科生开讲“求是大讲堂”通识课程第六课。除浙江大学大健康学院院长外,高福目前还是中国科学院病原微生物与免疫学重点实验室主任、中国生物工程学会理事长、中华医学会副会长。
2.广东省中医院又一临床科室成立。3月8日,广东省中医院举行康复科大科成立大会。康复科大科涵盖大学城医院康复科、大德路总院康复科、语言认知中心、理疗科、珠海医院康复科,由2个住院部和5个门诊部组成,开放床位84张。拥有医护治人员共148人。欧海宁任康复科大科主任。康复科大科旨在构建从“急性期-恢复期-后遗症期”全程康复立体诊疗模式,为各种功能障碍患者提供最优最及时的中西医结合综合康复方案。
3.韩国向4944名拒绝复工医生发吊销执照通知。据韩联社等媒体11日报道,政府已向近5000名拒绝复工的医生发送吊销执照通知,并决定从当天起向20家医院派遣20名军医官、138名公共卫生医师,以解燃眉之急。截至8日,韩国保健福祉部共向4944名拒绝复工的实习和住院医师发送吊销医师执照的预告通知,并正在向其余罢工医生逐一发送该通知。此外,为协助已复职或有意复职的医生,韩国政府将于12日起设立运营“保护与举报中心”,并开通电话和短信举报热线。
评审动态
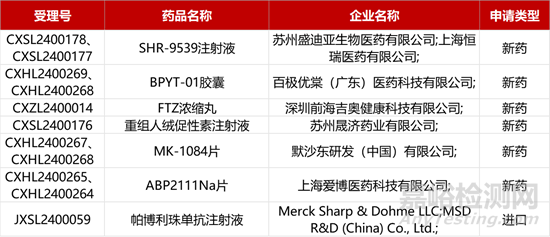
1. CDE新药受理情况(03月12)
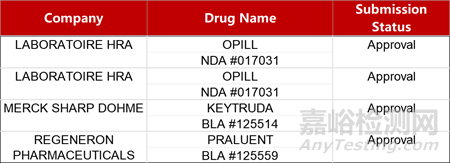
2. FDA新药获批情况(北美03月11日)