今日头条
必贝特双靶点PI3K/HDAC抑制剂报产。必贝特医药PI3K/HDAC双靶点1类新药注射用双利司他(BEBT-908)的上市申请获CDE受理,用于治疗既往至少两种系统疗法经治的复发或难治性弥漫性大B细胞淋巴瘤(r/r DLBCL)成人患者。在Ⅱa期临床中,由独立影像评估委员会(IRC)评估和研究者评估的客观缓解率(ORR)均高于与CDE达成的附条件上市要求,且双利司他可显著延长患者的总生存期。
国内药讯
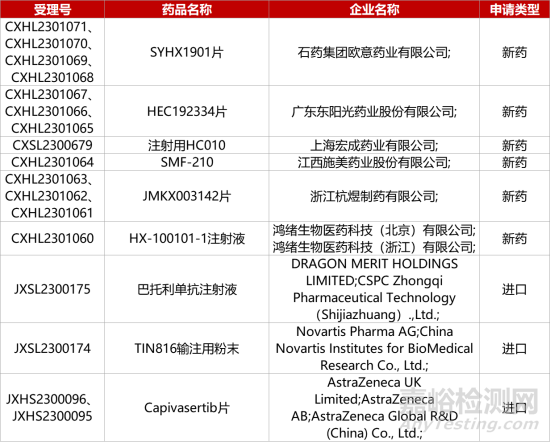
1.阿斯利康AKT抑制剂中国报产。阿斯利康AKT抑制剂Capivasertib上市申请获CDE受理,推测适应症为“联合Faslodex(氟维司群)治疗内分泌疗法经治、HR+/HER2-局部晚期或转移性乳腺癌患者”。在国际III期CAPItello-291研究中,这一组合使患者疾病进展或死亡风险降低40%。今年6月,FDA已受理该组合疗法新药申请(NDA)并授予优先审评资格,PDUFA日期为2023年第四季度。
2.甘李2款速效胰岛素欧洲报产。甘李药业门冬胰岛素注射液(商品名为锐秀霖)和赖脯胰岛素注射液(商品名为速秀霖)的上市许可申请(MAA)获得欧洲药品管理局(EMA)受理,两款胰岛素类似物均适用于与长效胰岛素联合使用,以实现糖尿病患者的基础与餐后血糖控制。锐秀霖皮下注射后10~20分钟内起效,作用持续时间为3~5小时;速秀霖皮下注射后10-15分钟起效,作用持续2-5小时。
3.罗氏GPRC5D/CD3双抗获批中国临床。罗氏靶向GPRC5D和CD3的双特异性抗体forimtamig(RG6234)获国家药监局临床试验默示许可,拟开发用于治疗多发性骨髓瘤。RG6234能够将T细胞募集到肿瘤周围,进而引发抗肿瘤免疫反应。公布于EHA2022年会上的Ⅰ期临床结果显示,forimtamig单药治疗在复发/难治性多发性骨髓瘤患者中的总缓解率(ORR)达到71.4%,其中52.4%的患者达到非常好的部分缓解。
4.麦济IL-4Rα单抗美国获批皮炎临床。麦济生物IL-4Rα单抗MG-K10(Comekibart)获FDA批准开展Ib期临床研究,评估用于美国成人中重度特应性皮炎患者中的安全性、药代动力学及初步有效性。MG-K10通过抑制Th2信号通路,有望靶向精准治疗中重度特应性皮炎、中重度哮喘等疾病。在国内,MG-K10已在治疗特应性皮炎的II期临床达到主要终点;该新药也正在II期临床中评估用于哮喘的治疗潜力。
5.恒瑞SHR-2022注射液获批肿瘤临床。恒瑞医药1类生物制品SHR-2022注射液获国家药监局临床试验默示许可,将针对晚期或转移性恶性肿瘤适应症开展临床试验。据悉,SHR-2022注射液可通过阻断免疫抑制性信号通路,增强适应性免疫应答。目前国内外尚无同类产品获批上市。据2023年披露的公告信息统计,该公司今年至少有46款药物获批临床试验。
6.科霸LILRB2/PD-L1双抗报实体瘤IND。科霸生物自主开发的靶向LILRB2和PD-L1的双特异抗体药物SPX-303向FDA递交临床申请,拟开展用于晚期或难治性实体瘤治疗的Ⅰ期临床试验。SPX-303同时阻断人体免疫系统的两个关键免疫检查点LILRB2和PD-L1,从而使免疫系统能够更高效地鉴别并有效地清除恶性肿瘤细胞。
国际药讯
1.太阳制药氘代芦可替尼报斑秃NDA。印度太阳制药口服JAK1/JAK2抑制剂氘代芦可替尼(Deuruxolitinib,CTP-543)用于治疗中重度斑秃(alopecia areata,AA)的新药申请获FDA受理。在两项III期研究(THRIVE-AA1和THRIVE-AA2)中,与安慰剂组相比,deuruxolitinib(8mg和12mg)组患者第24周实现脱发严重程度SALT评分≤20分的比例显著更高(29.6%和41.5%,vs0.8%;33.0%和38.3%,vs0.8%)。
2.IL36R抗体泛发性脓疱性银屑病Ⅲ期临床积极。AnaptysBio公司IL36R单抗imsidolimab治疗泛发性脓疱性银屑病(GPP)复发患者的国际Ⅲ期GEMINI-1试验达到主要终点。与安慰剂相比,单次静脉注射Imsidolimab(750mg)第4周时显著提高达到皮肤症状GPPPGA 0/1(清除或几乎清除)的患者比例(53.3%vs13.3%,p=0.0131);药物耐受性良好,无严重不良反应。该公司计划在2024年第三季度向FDA递交上市申请。
3.Veru公司AR调节剂启动增肌Ⅱb期临床。Veru公司选择性雄激素受体调节剂(SARM)enobosarm将开展一项Ⅱb期临床,评估用于接受GLP-1R激动剂司美格鲁肽或tirzepatide治疗的肥胖症患者中,进一步减少患者脂肪量、并防止肌肉萎缩和骨密度下降的有效性和安全性。此前,在老年男性和绝经后女性中,enobosarm治疗已显示出减少脂肪量、显著增加肌肉质量,并改善肌肉强度和身体功能的潜力。
4.H3R拮抗剂治疗过度嗜睡Ⅱ期临床积极。Harmony Biosciences选择性H3R拮抗剂/反向激动剂pitolisant(Wakix)治疗Prader-Willi综合征(PWS)患者的白日过度嗜睡(EDS)症状的Ⅱ期临床最新数据积极。在6岁-12岁队列中,pitolisant均能改善ABC-2(异常行为量表-2)所涵盖的行为障碍指标;pitolisant组患者在针对EDS的照料者整体严重性印象评分(CaGI-S)的降低也更大。该公司计划在2023年第四季度启动Ⅲ期注册TEMPO研究。
5.FIC新药奥尔波特综合症Ⅱ期临床积极。Eloxx公司潜在“first-in-class”小分子氨基糖苷类药物ELX-02治疗携带无义突变的奥尔波特综合征(Alport syndrome)患者的Ⅱ期临床结果积极。ELX-02旨在通过与核糖体RNA复合体结合,让核糖体可以通读(read through)无义突变导致过早出现的终止密码子,以促进完整蛋白的生成。肾脏组织最新分析显示,在所有3例接受治疗的患者中,ELX-02平均改善肾脏足细胞形态指标60%。尿蛋白肌酐比值(UPCR)评估显示蛋白尿水平稳定或得到改善。
6.RNAi疗法治疗ATTR-CM上市遭拒。Alnylam公司RNAi疗法patisiran(Onpattro)治疗转甲状腺素蛋白淀粉样变性心肌病(ATTR-CM)的补充上市申请(sNDA)收到FDA完整回复函。FDA认为现有数据不足以支持sNDA申请。Patisiran是FDA批准的首款RNAi疗法,此前已获批用于治疗遗传性转甲状腺素蛋白淀粉样变性多发性神经病(ATTR-PN)。Alnylam表示将专注另一款RNAi疗法vutrisiran治疗ATTR-CM的III期HELIOS-B研究,不再寻求扩大Patisiran的美国适应症。
医药热点
1.美国Kinnate公司关闭中国子公司。近日,美国肿瘤生物制药公司Kinnate更新研发管线和调整战略以削减运营开支,宣布暂停部分管线并裁撤70%的员工。此次裁员,包括遣散Kinnate在中国的全资子公司,即经久生物的所有员工。经久生物于2021年5月由Kinnate与多家投资机构共同成立,公司总部设立在上海。根据此前规划,经久生物负责Kinnate靶向肿瘤药物在大中华区(包括中国大陆、香港、台湾和澳门)的研发和商业化。
2.腔面型乳腺癌“复旦分型”发布。复旦大学附属肿瘤医院邵志敏、江一舟教授团队,联合复旦大学生命科学院和人类表型组研究院,以及上海市生物医药技术研究院的研究人员历时5年攻关,绘制了全球最大的腔面型乳腺癌多组学全景图谱,并提出“复旦腔面四分型”基础上的精准治疗策略。该项重要成果已于近日发表在国际顶级期刊《自然·遗传学》。
3.广东:进一步限制采购进口医疗设备。近日,广东省财政厅印发《政府采购常见问题清单》,列举出政府采购活动中的64类禁止性情形,多项限制国产、违规采购进口设备的行为也被纳入其中。其中,《清单》第19类第61项要求:“禁止将除进口货物以外的生产厂家授权、承诺、证明、背书等作为资格要求和符合性要求”。也就是说,在医疗器械招标采购活动时,对于国产产品设立一些厂家授权、承诺、证明、背书等作为资格要求和符合性要求的不合理招标标准是严格禁止的。
评审动态
1. CDE新药受理情况(10月10日)
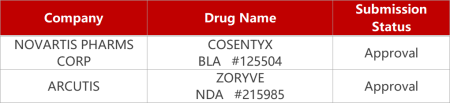
2. FDA新药获批情况(北美10月06日)