今日头条
兴齐低浓度阿托品报儿童近视NDA。兴齐眼药硫酸阿托品滴眼液(SQ-729)2.4 类化药上市申请获国家药监局受理,用于延缓儿童近视进展。在Ⅲ期研究中,与安慰剂组相比,硫酸阿托品滴眼液组在主要疗效指标上有统计学意义的显著性差异,而且硫酸阿托品滴眼液安全性良好,患者使用依从性好。目前,国内尚无延缓儿童近视进展的低浓度硫酸阿托品滴眼液获批上市。
国内药讯
1.合肥天麦引进口服胰岛素报产。天麦生物从以色列Oramed公司引进的重组人胰岛素肠溶胶囊(ORMD-0801)的上市申请获国家药监局受理,用于治疗口服降糖药疗效不佳的2型糖尿病(T2DM)患者。该产品为全球首款申报上市的口服胰岛素制剂。今年1月,Oramed公司曾宣布ORMD-0801在治疗T2DM的III期临床(ORA-D-013-1研究)未达到主要终点和次要终点,与安慰剂相比,ORMD-0801未能显著改善患者的血糖控制。
2.智翔金泰TSLP双抗获批哮喘临床。智翔金泰1类生物制品GR2002注射液获国家药监局临床许可,拟开发用于哮喘的治疗。GR2002是智翔金泰自主研发的抗TSLP双特异性抗体,也是全球首个获批临床的TSLP双表位双抗,它具有共同轻链Fab+Fab双抗结构,具有临床多次给药的开发潜力。目前,全球仅有阿斯利康和安进合作开发的TSLP靶向药物tezepelumab(Tezspire)上市,该产品2022年销售额达到1.74亿美元。
3.上海先博CD19靶向CAR-NK在华报IND。先博生物1类生物制品靶向CD19的嵌合抗原受体基因修饰的NK细胞注射液的临床试验申请获CDE受理。2022年7月,先博生物通用型CD19 CAR-NK疗法的安全性、有效性已得到初步临床验证。首例复发难治性弥漫大B细胞淋巴瘤患者,在接受低剂量单次输入28天后,PET肿瘤评估提示多处病灶明显缩小甚至消失,疗评判定为CMR(完全代谢缓解)。
4.北京曙方引进DMD新药报IND。Santhera公司与曙方医药合作开发的1类化药vamorolone口服混悬液的临床试验申请获CDE受理。vamorolone是一款潜在“first-in-class”类固醇药物,FDA已于2023年1月受理该新药用于治疗杜氏肌营养不良(DMD)的新药上市申请,PDUFA日期预定为2023年10月26日。在Ⅱb期临床VISION-DMD中,vamorolone的疗效与强的松相比达到非劣效标准;而且并未发现vamorolone在骨骼健康生物标志与线性生长上有负面的影响。
5.远大收购液体栓塞剂公司BlackSwan。远大医药宣布已签订股权收购协议,以不超过3750万美元从BlackSwan Vascular原股东收购该公司的87.5%股权,并获得该公司Lava和Kona两款产品的全球权益。Lava是一款创新液体栓塞剂,已于2023年4月获FDA批准上市,用于治疗外周血管动脉出血;Kona是一款拟用于脑动静脉畸形的术前栓塞产品,目前已向FDA递交了上市前审批(PMA)申请,预计在2023年末获批上市。
国际药讯
1.蓝鸟SCD基因疗法在美报BLA。蓝鸟生物一次性基因疗法lovotibeglogene autotemcel(lovo-cel)已向FDA提交生物制品许可申请(BLA),用于治疗镰状细胞贫血(SCD)患者。该项申请包括优先审评资格的请求。Lovo-cel旨在将改良形式的β-珠蛋白基因(βA-T87Q珠蛋白基因)的功能拷贝添加到患者自身的造血干细胞(HSCs)中,恢复其产生抗镰状血红蛋白(HbAT87Q)功能,以达到治疗目的。此前,lovo-cel已获得FDA授予的孤儿药资格、快速通道资格、再生医学先进疗法认定(RMAT)和罕见儿科疾病认定。
2.阿斯利康ASO药物III期临床成功。阿斯利康与lonis公司开发的反义寡核苷酸(ASO)药物eplontersen在AAN年会上公布用于治疗遗传性转甲状腺素蛋白(TTR)介导的淀粉样变多发性神经病变(ATTRv-PN)的III期NEURO-TTRansform研究66周分析数据。与安慰剂相比,eplontersen治疗显著降低患者血清TTR浓度较基线的降幅(82%vs11%,p<0.0001),该组mNIS+7评分较基线只增加0.28分(vs25.06分),神经病变有所缓解的患者比例达到47%(vs17%);药物的安全性与已知研究一致。
3.Bcl-xL抑制剂DME临床长期疗效积极。UNITY Biotechnology公司细胞凋亡抑制蛋白Bcl-xL抑制剂UBX1325治疗糖尿病黄斑水肿(DME)患者Ⅱ期BEHOLD试验48周随访结果积极。UBX1325单次注射使患者的平均最佳矫正视力(BCVA)较基线显著提高了+6.2 ETDRS字母;患者黄斑中心凹视网膜厚度(CST)的改善持续48周;随访期间无需接受标准治疗的患者比例达到53%。UBX1325总体耐受性良好。
4.FIC合成致死疗法黑色素瘤Ⅱ期临床积极。IDEAYA Biosciences公司潜在“first-in-class”蛋白激酶C(PKC)抑制剂darovasertib与克唑替尼(crizotinib)合成致死组合疗法用于治疗转移性葡萄膜黑色素瘤(MUM)患者的Ⅱ期临床结果积极。在初治患者中,确认ORR为45%,DCR为90%,患者中位无进展生存期(PFS)约为7个月;在总体患者群中,确认ORR为30%,DCR为87%,中位PFS约为7个月。IDEAYA计划尽快启动一项Ⅱ/Ⅲ期临床,针对初治HLA-A2阴性MUM患者。
5.礼来出售鼻喷升血糖疗法。礼来宣布已与Amphastar公司达成授权许可协议,将高血糖素鼻用粉雾剂(Baqsimi)的全球权益出售给Amphastar。根据协议,礼来将在交易完成时获得5亿美元现金,交易完成一周年时获得1.25亿美金,以及总金额高达4.5亿美元的销售里程金。Baqsimi是FDA批准的首款胰高血糖素鼻喷剂,用于4岁及以上年龄糖尿病患者严重低血糖的治疗。
6.Apellis终止补体C3疗法一项II期临床。Apellis公司已停止补体C3疗法pegcetacoplan用于治疗肌萎缩侧索硬化症(ALS)的II期临床(MERIDIAN)扩展研究。原因是数据监测委员会在非盲法审查后有了新的见解,患者无需接受pegcetacoplan进一步治疗。2021年5月,FDA批准Empaveli(pegcetacoplan)上市,用于治疗阵发性睡眠性血红蛋白尿症(PNH);今年2月,FDA批准该产品扩展适应症,治疗由年龄相关性黄斑变性(AMD)引起的地图样萎缩(GA),商品名:Syfovre。
医药热点
1.卫健委发文推进加速康复外科建设。近日,国家卫健委办公厅发布《关于进一步推进加速康复外科有关工作的通知》,进一步推进加速康复外科诊疗理念和诊疗模式在外科领域的应用。《通知》提出,有关医疗机构要加强手术科室建设,强化相关科室设备设施配备和人才队伍建设,加强相关诊疗指南、技术操作规范相关培训。同时加强精神(心理)科、麻醉科、手术室、药学部、康复医学科、医学影像科等建设,围绕外科手术患者诊疗需要,全面提升医疗服务能力。
2.中国科学家研究出新方法诊断早期癌症。4月21日,中国科学院大学研究团队在《Science Advances》上发表的最新研究显示,研究人员制作的微流控装置完全由气动时钟脉冲发生器驱动,可以在30分钟内直接从血液中高产、高纯度的分离EVs。通过使用热敏感应器检测患者血液中分离的EVs的蛋白质标记物来证明其临床效用,诊断早期乳腺癌的准确性高达91%。
3.来华人员不再查验核酸检测。中国外交部发言人毛宁25日在例行记者会上宣布,为进一步便利中外人员往来,本着科学、精准、安全、有序的原则,中方将进一步优化远端检测安排。自4月29日起,所有来华人员可以登机前48小时内抗原检测代替核酸检测,航空公司不再查验登机前检测证明。
评审动态
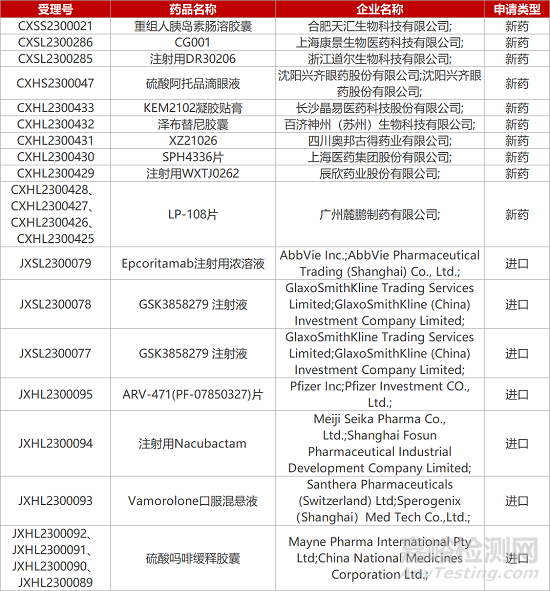
1. CDE新药受理情况(04月25日)
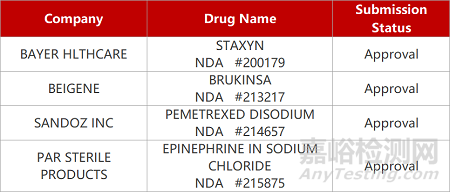
2. FDA新药获批情况(北美04月24日)