您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2022-10-31 15:03
水,也许是最容易被忽视的API生产原料,但它却无处不在,API的生产、成品药的制剂、设备的清洗,任何环节恐怕都离不开水的存在。水的品质会为药物的生产带来如何的影响?如何制定合理的水质量标准以确保API产品的效果与安全?
FDA在其指南中将水划分为8 个类型:
·非饮用水(Non-potable)
·饮用水(potable)
·美国药典纯化水(USP purified water)
·USP 注射用水 (WFI, USP water for injection)
·USP 无菌注射用水(USP sterile water for injection)
·LUSP 无菌吸入水 (LUSP sterile water for inhalation)
·USP 抑菌注射用水(USP bacteriostatic water for injection)
·灌溉用 USP 无菌水(USP sterile water for irrigation)
USP 名称意味着水是当前美国药典官方专著的主题,每种类型都有各种规格。USP 纯化水和 USP WFI 是 USP 所称的“成分材料”,旨在用于原料药及成品药的生产。
纯化水是制药工业最常用的水类型,作为加工、制剂和生产药物和其他活性成分的主要原料之一。纯化水可用于重构产品、辅助合成、作为清洁剂以及用于生产成品药。一般来说,水可以分为两种类型:散装水和包装水。散装水通常在使用地点生产。包装水是将水生产、包装和消毒以延长产品保质期并保持其微生物品质。根据具体的制药情况,需要不同的水等级。
欧洲药典和美国药典都对用于制造 API 的纯化水有严格的定义。世界上其他几个国家也有针对医药级水的生产和质量保证要求的药典标准,包括中国、日本和印度。例如,最近更新的中国药典,其质量控制和技术要求更接近国际标准(表1)。
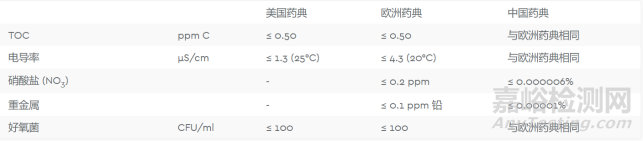
表1. 美国药典、欧洲药典、中国药典纯化水质量标准(部分)对比
纯化水被视为一种赋形剂,用作生产非胃肠道制剂和其他制药应用,例如非肠胃外产品接触部件和设备的清洁。除非另有规定,纯化水也应用作所有测试和分析过程的最低水质。用于生产纯化水的最低质量水源是饮用水(potable water),但是饮用水作为一种成分呢?生产使用前是否需要进行例行抽样检测?根据 CGMPs的序言规定,饮用水不需要进行验收测试,除非它是从不按照环境保护署 (EPA) 标准控制水质的水源获得的。重要的是要知道,饮用水不得用于制备 USP 剂型的成品药或用于实验室试剂来测试溶液。然而,饮用水可用于制造API。饮用水的属性已被美国环保署、欧盟、日本或世界卫生组织明确规定。纯化水的制备可以通过包括去离子、蒸馏、离子交换、反渗透、过滤或其他净化单元操作来处理饮用水,所以在工业界纯化水也经常被称作process water,尽管后者涵盖了很广的范围和质量标准。纯化水必须满足离子和有机化学纯度的要求,并且必须防止微生物污染。纯化水系统必须经过验证,保证可靠并一致地生产化学和微生物质量可接受的生产用水。
在室温环境下操作的纯化水系统特别容易形成微生物的生物膜,这可能是水中活微生物或内毒素的主要来源。这些净化水系统需要经常进行消毒和微生物监测,以确保水质达标(微生物与内毒素)。纯化水专论还允许散装包装用于其他地方的商业用途。与无菌纯净水相比,包装的纯净水不需要是无菌的,但需要及时使用并注意水质变化。另外,可提取的化合物可能会从包装中渗入水中。
饮用水通常也是用于制备原料药的可接受的最低级别的水质。在与工艺兼容的情况下,饮用水中允许的污染物水平通常被认为可安全用于制备原料药。当然,如果原料药生产对于纯度有特殊要求的话,例如对产品中的亚硝酸盐、亚硝胺杂质等有很高的要求,原料药的生产工艺,尤其是最后一步的工艺,需要级别更高的水,甚至可能需要像注射用水那样的级别。然而实际的生产可能并不需要全方面的高标准,只是对于某些特定的属性(例如上面说到的亚硝酸盐含量)有比饮用水更高的要求。水质的标准也取决于原料药的生产步骤,原料药中间体的阶段可以使用饮用水,因为接下来的步骤中会有溶剂添加或者蒸馏等步骤,这些溶剂的处理可以抑制微生物的生长。图1显示了FDA对于原料药与制剂生产水质选择的指南。它们根据药物递送作为标准对水质的需求进行了区分。
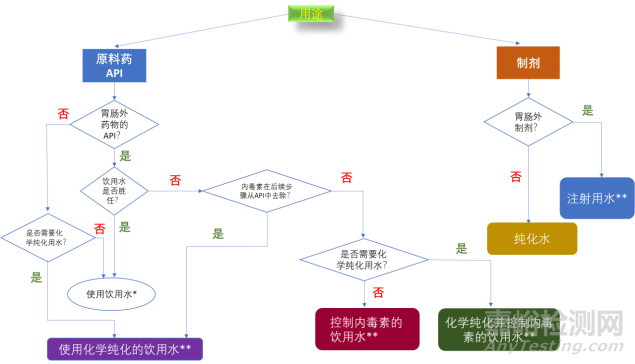
图 1. 制药用水的选择:原料药和成品药。(*饮用水符合美国 EPA NPDWR 或欧盟或日本的饮用水法规或 WHO 饮用水准则。**如果在工艺中没有后续的灭菌步骤,则无菌 API 剂型用水必须首先进行无菌处理。)
虽然在这份指南中允许饮用水、化学纯化的饮用水、控制内毒素的饮用水,或者化学纯化并控制内毒素的饮用水作为原料药生产用水,但在实际工业生产中,原料药生产的最后一步通常会使用纯化水作为原料。例如多肽原料药生产的反相色谱纯化,使用的洗脱液的水组分通常为纯化水。需要注意的是,在原料药生产的最后阶段,使用符合监管合规标准的水净化系统至关重要。此类系统将风险降至最低,确保水质易于测量并作为 QC 过程的一部分记录。它们还最大限度地减少人为错误的可能性,最大限度地减少停机时间。
EMA对于不同原料药的生产以及不同步骤的用水标准也做出了建议,其指南内容见表2。
|
原料药类型/用途 |
生产步骤 |
最低水质要求 |
|
对原料药或成品药没有无菌或无热原性要求 |
原料药最终分离或者纯化步骤之前的全部中间体阶段 |
饮用水* |
|
最终分离纯化 |
||
|
草药提取 |
用于制备提取物的水** |
|
|
原料药是发酵产物或生物制品,不是疫苗或先进疗法药物产品。 |
发酵培养基和细胞培养基 |
饮用水* |
|
原料药用于生产疫苗。 也适用于先进疗法药物产品和用于制造先进疗法药物产品的起始材料,这些材料经过灭菌步骤(如病毒载体)。 |
发酵培养基和细胞培养基 |
纯化水 |
|
原料药旨在用于制造先进疗法药物产品,并且不受后续灭菌步骤的影响(例如基于细胞的产品)。 |
所有步骤包括发酵培养基、细胞培养基、初始纯化、最终分离和纯化。 |
注射用水 |
|
原料药为溶液,非无菌,用于肠胃外使用。 |
除最终分离和纯化外的任何步骤。 |
纯化水 |
|
最终分离纯化 |
注射用水 |
|
|
原料药非溶液,不是无菌的,旨在用于肠胃外产品。 |
最终分离纯化 |
纯化水*** |
|
原料药不是无菌的,用于制备非无菌疫苗以供肠胃外使用。 |
最终分离纯化 |
纯化水 |
|
原料药不是无菌的,旨在用于无菌、非肠道产品。 |
最终分离纯化 |
纯化水**** |
|
原料药是无菌的,不用于肠胃外使用。 |
最终分离纯化 |
纯化水 |
|
原料药是无菌且无热原的。 |
最终分离纯化 |
注射用水 |
表2. EMA建议的原料药生产用水标准
*如果有更高化学纯度的技术要求,则应使用纯化水。
**参见专著2249“用于制备提取物的水”。
***根据相关的欧洲药典,必须为原料药的内毒素和微生物含量设定适当的质量标准。
****根据相关的欧洲药典,必须为原料药的微生物含量设定适当的质量标准。

来源:药研


