您当前的位置:检测资讯 > 法规标准
嘉峪检测网 2022-10-09 15:34
今日,国家药监局器审中心发布《疝修补补片产品注册审查指导原则(征求意见稿)》
疝修补补片产品注册审查指导原则
(征求意见稿)
本指导原则旨在为药品监管部门对疝修补补片注册申报资料的技术审评提供技术指导,同时也为注册申请人进行疝修补补片的注册申报提供参考。
本指导原则系对疝修补补片注册申报资料的一般要求,注册申请人可依据具体产品的特性对注册申报资料的内容进行充实和细化。注册申请人还可依据具体产品的特性确定其中的具体内容是否适用,若不适用,需具体阐述其理由及相应的科学依据。
本指导原则是对注册申请人和技术审评人员的指导性文件,但不包括注册审批所涉及的行政事项,亦不作为法规强制执行,如果有能够满足相关法规要求的其他方法,也可以采用,但是需要提供详细的研究资料和验证资料。应在遵循相关法规和标准的前提下使用本指导原则。
本指导原则是在现行法规和标准体系以及当前认知水平下制定的,随着法规和标准的不断完善,以及科学技术的不断发展,本指导原则相关内容也将进行适时的调整。
一、适用范围
本指导原则所涉及的疝修补补片是指植入体内以修补疝或腹壁缺损、加强薄弱腹壁的补片类产品,材料涵盖聚丙烯/聚酯/聚四氟乙烯/聚偏二氟乙烯等不可吸收合成材料、聚乳酸/聚己内酯等可吸收合成材料、动物源性材料、同种异体材料、复合材料等。
二、注册审查要点
注册申报资料宜符合国家药品监督管理局《关于公布医疗器械注册申报资料要求和批准证明文件格式的公告》中对注册申报资料的要求,同时宜符合以下要求:
(一)监管信息
1.管理类别
该类产品在《医疗器械分类目录》中分类编码为13-09-04。产品的管理类别为Ⅲ类。
2.注册单元划分
申报产品注册单元划分需依据《医疗器械注册与备案管理办法》、《医疗器械注册单元划分指导原则》要求,着重考虑产品的技术原理、结构组成、性能指标及适用范围等因素。可考虑划分为不同注册单元的情况举例:
(1)不同的材料组成/化学成分;
(2)不同的适用范围,如:因放置在腹腔内和腹腔外而设计不同的补片。
①下列适应证补片可能会放置在腹腔内:补片置入腹腔内的腹壁疝(手术切口疝、造口疝、脐疝、白线疝、半月线疝等)、食管裂孔疝、膈疝、盆底疝等。
②下列适应证补片可能会放置在腹腔外:补片不置入腹腔内的腹壁疝(手术切口疝、造口疝、脐疝、白线疝、半月线疝等)、腹股沟疝、股疝等。
(二)综述资料
1.器械及操作原理描述
(1)产品名称
提供申报产品名称的确定依据。产品名称需符合《医疗器械通用名称命名规则》、《无源植入器械通用名称命名指导原则》等相关文件的要求。产品通用名称一般为“疝修补补片”,可增加其他合适的特征词。
(2)需描述产品工作原理、作用机理、各组件在产品中的功能、各组件连接方式(适用于多组件连接的产品)、区别于其他同类产品的特征等。
(3)产品结构及组成
①疝修补补片的总体外型描述(平片/立体、单层/多层)及图示(参考下文示例):提供产品形状(矩形平片、椭圆形平片、立体三维结构等)、尺寸(如长度、宽度、厚度、单丝直径、孔尺寸/孔面积等)、网孔密度/网孔比例(含有编织网孔的补片,必要时提供图示标注网孔测量尺寸)、孔隙率(含有微孔结构设计的补片)、编织特性(如双纤维交替编织等)及图示(参考下文示例)、多层补片各层间连接方式(超声热合、缝合等)、单位面积重量(g/m2,对于部分可吸收产品还需单独明确不可吸收主体部分的单位面积重量)等信息。参照附录一表1形式分别列出产品的基本信息(可根据具体情况增减项目)。
②提供产品典型型号规格的整体结构示意图、局部细节示意图(如编织方式、孔隙结构、分层结构图示、染色位置及范围),必要时同时提供补片正面及侧面示意图以表现产品的立体结构。若材料设计、编织工艺等原因导致补片具有各向异性,产品示意图中明确纵向、横向的具体方向。对于由多个部件组成的产品,需提供每个组成部分的结构描述及相应图示(例如多种纤维混合编织、特殊功能的膜层、加强环、支撑环、提拉带、置入工具等)。图示举例见附录一图1、图2。
(4)产品组成材料
①明确疝修补补片各部件所有组成材料的基本信息,如:化学名称、化学结构式/分子式(如适用)、材料商品名(如适用)、材料代号/牌号(如适用)等。上述基本信息对于由动物或人体组织材料经处理制成的产品可能不适用。
②对于动物源性材料,明确动物种类及取材部位。
③对于同种异体材料,明确取材部位。需对供体进行人免疫缺陷病毒、乙型肝炎病毒、丙型肝炎病毒、梅毒螺旋体等病毒和/或传染性病原体的检测,并概述检测方法(其中人免疫缺陷病毒需采用PCR方法检测)。
④若原材料外购,需明确原材料供应商,提交原材料的质控标准及检测报告。如适用,注册申请人可提交主文档授权信,并对主文档引用的情况进行说明。若原材料为自行合成,需阐述材料生产过程中的质量控制标准并提交相关的检测报告。
2.型号规格
提供产品各型号规格的划分依据,明确各型号间的异同点(同一型号系列的产品需具有材料、特性、结构上的同一性)。
3.包装说明
说明与灭菌方法相适应的产品无菌屏障系统的信息。建议列表提供包装结构示意图、材料、尺寸等,并明确与产品一起销售的附件的包装情况(如适用)。
4.研发历程及与同类和/或前代产品的参考和比较
阐述申请注册产品的研发背景和目的。如有参考的同类产品或前代产品,应当提供同类产品或前代产品的信息,并说明选择其作为研发参考的原因。以对比表形式,比较说明申报产品与同类产品和/或前代产品在工作原理、结构组成、制造材料、性能指标、作用方式,以及适用范围等方面的异同。如与参考产品存在差异,宜结合差异及安全有效清单要求,分析差异是否需要进行额外的、特殊的安全有效性评价。
5.适用范围和禁忌证
注册申请人需根据临床资料规范申报产品的适用范围,如限定使用部位。一般情况描述为:该产品适用于外科或腹腔镜手术中××部位××疝的修补。
(三)非临床资料
1.产品的风险管理资料
根据YY/T 0316《医疗器械 风险管理对医疗器械的应用》,对疝修补补片的原材料、生产加工过程、产品包装、灭菌、运输、贮存、使用等产品寿命周期的各个环节,从能量危害(若涉及)、生物学危害、环境危害、有关使用的危害、由功能失效、维护、老化引起的危害等方面进行风险分析,详述所采取的风险控制措施。对于含有动物源性材料成分的产品,参照《动物源性医疗器械产品注册申报资料指导原则》完善产品风险管理资料。
2.产品技术要求
疝修补补片参考的主要相关国家标准及行业标准举例见参考文献部分(未标明年代号表示应参照最新标准),同时产品技术要求需按照《医疗器械产品技术要求编写指导原则》的要求进行编制。
(1)产品型号规格及其划分说明
明确产品型号规格,阐明各型号规格间的区别及划分说明,型号规格的表述需在全部注册申报资料中保持一致。
(2)性能指标
产品性能指标可参考附录二制定,对于可进行客观判定的成品的功能性、安全性指标,应将其列入产品技术要求。注册申请人需依据具体产品的特性确定各性能指标是否适用,若不适用需详细说明理由并提供支持性资料。注册申请人需开发相关的检测方法保证产品技术要求中的项目采用成品进行测试,若现有技术不能在成品上检测该项目,则提供使用中间品或原材料开展该项目的研究资料,同时需要论证产品技术要求中其他替代项目支持了相关的功能性或安全性。如产品有特定设计,注册申请人还应根据产品设计特征设定相应的性能指标,并将其列入产品技术要求。
(3)检验方法
产品的检验方法需根据技术性能指标设定,检验方法宜优先采用国家标准/行业标准中的方法。对于相关国家标准/行业标准中不适用的条款,需说明不适用的原因。所有引用的标准注明其编号、年号或版本号。自建检验方法可以附录形式采用相应图示进行说明。
(4)附录
建议注册申请人以资料性附录形式提供产品的结构图示及材料信息,内容及形式可参考综述资料部分。
3.产品检验报告
提供检验样品型号规格的选择依据。所检验型号规格需为能够代表本注册单元内所有型号规格的典型产品。若一个型号规格不能覆盖,除选择典型型号规格进行全性能检验外,还应选择其它型号规格产品进行补充性检验。
一般情况下,若注册申报各型号的材料组成及化学成分完全相同时,对采用不同编织形式的型号,例如不同的编织方法、单丝直径、纤维数量、孔尺寸/孔面积等,可考虑分别检测编织形式的差异所影响到的相关产品物理性能。
4.产品性能研究
(1)说明产品技术要求中性能指标及检验方法的确定依据,需提供采用的原因及理论基础。依据产品性能研究结果,结合临床需求制定性能指标接受标准。对于自建方法,需提供相应的依据、理论基础及方法学验证资料,同时保证检验方法具有可操作性和可重现性。
(2)对于疝修补补片,性能研究项目包括但不限于附件表格所列项目。注册申请人需根据具体产品特性,考虑增加其他适用的性能研究项目。对于附件表格列举的项目中,如有不适用项,亦需说明具体理由。性能研究宜采用终产品,选择典型型号规格。若受实验条件等因素影响,未使用终产品时,请提供替代样品的合理理由及依据。研究项目所用样本数量宜适当,同时结合风险和伤害情况等因素确定数量,适用时对验证结果进行统计学分析。
(3)性能研究资料至少包括以下内容:
①性能研究汇总列表,包括研究项目、接受标准、试验方法简述、参考技术文件、测试型号规格、测试样品批号、样品数量等。
②各研究项目的接受标准及确定依据。
③各研究项目的具体实验方法。
④典型型号规格及选择依据,不同研究项目选择的典型型号规格不同时,宜分别明确。
⑤研究项目所用样品数量及确定依据,每个研究项目宜分别明确样品数量,对于需要结合统计学考虑样品数量的研究项目宜明确样品数量确定依据。
⑥研究结果及分析、研究结论。如为定量指标,宜采用数值表示结果,提供测试值总结。
(4)对部分性能研究项目的说明
①提供与临床应用相关的产品结构、组成及性能方面的设计验证资料,如立体结构设计、多层复合设计等。
②测试最终产品中任何有潜在毒性、致癌性的化学成分含量,如有机溶剂、重金属、交联剂等,并提供以上物质的人体限量/阈值及其依据。
③对于含有可降解/可吸收成分的产品,提供产品降解周期的研究资料,提供产品及降解产物在体内代谢情况的支持性资料。
④对于长期植入体内可能发生皱缩的疝补片产品,提供相关支持性资料,评价因皱缩带来的疝复发等风险。
5.生物学特性研究
疝修补补片属于与组织持久接触的植入性医疗器械,需参照GB/T 16886《医疗器械生物学评价》进行生物学评价,需考虑的生物相容性风险包括但不限于:细胞毒性、迟发型超敏反应、皮内反应、遗传毒性、局部植入反应、急性全身毒性、亚慢性毒性、材料介导的致热性等。
若申报产品中的材料从未在国内已上市的长期植入性医疗器械中使用,需明确该材料中是否存在潜在毒性、致癌性、免疫原性物质,并需对材料的长期生物相容性进行评价,如长期植入反应、慢性毒性、致癌性等,并对其植入人体后的稳定性进行评价。
6.生物安全性研究
对于含有动物源性材料成分的产品,需明确动物地理来源、动物种类、年龄、取材部位、组织性质,参照《动物源性医疗器械产品注册申报资料指导原则(2017年修订版)》完善产品生物安全性研究资料。
对于含有同种异体材料成分的产品,考虑到可能引发的伦理问题,注册申请人需提供与组织供应单位签署的长期协议及供体志愿捐赠书。在志愿捐赠书中,需明确供者所献组织的实际用途,并由供者本人/其法定代理人/其直系亲属签名同意。注册申请人还需提供对保存供体可追溯性文件的承诺。提供供者可能感染的病毒和/或传染性病原体(如人免疫缺陷病毒、乙型肝炎病毒、丙型肝炎病毒、梅毒螺旋体等)的检验资料,包括供体血清学检测报告、检测所用的具体方法及依据等,其中人免疫缺陷病毒需采用聚合酶链式反应(PCR)方法检测。需提供病毒和/或传染性病原体的风险分析并详述相应的控制措施,参照《同种异体植入性医疗器械病毒灭活工艺验证技术审查指导原则》提供灭活和去除病毒和/或传染性病原体工艺有效性的验证试验数据。提供涉及产品免疫原性(免疫反应)的风险分析、控制工艺描述及验证性资料。
7.灭菌工艺研究
明确灭菌工艺(方法和参数)和无菌保证水平(SAL)。提供灭菌确认报告。疝修补补片的无菌保证水平需达到10-6,除非有无法实现的充分理由以及其无菌保证水平可接受的证明。
提供产品对灭菌工艺耐受性的支持性资料。
对于经辐照灭菌的产品,明确辐照剂量并提供其确定依据。如果采用环氧乙烷灭菌法,需确定环氧乙烷、2-氯乙醇等适用的相关衍生物在产品上的残留水平、最高残留上限并提供其依据。
8.动物试验研究
参照《医疗器械动物试验研究注册审查指导原则 第一部分:决策原则》确定是否需要进行动物试验。
对于经决策需开展动物试验的腹腔内置入的疝修补补片,需参照《腹腔内置疝修补补片动物试验技术审查指导原则》提供产品植入动物腹腔内的试验资料,记录并分析补片与腔内组织的粘连情况,以验证产品可用于腹腔内疝修补。
对于经决策需开展动物试验的具有重塑及再生功效的疝补片,提供相关功效的动物试验研究资料,评价补片植入动物体内后的组织重塑再生过程与结果,收集重塑再生的组织病理学证据及不同观察点取出物主要物理性能数据(例如拉伸强度、顶破强度等)。
参照《医疗器械动物试验研究注册审查指导原则 第二部分:试验设计、实施质量保证》设计并开展动物试验,提供规范的动物试验研究资料。
9.稳定性研究
注册申请人需提供货架有效期、使用稳定性、运输稳定性研究资料。
货架有效期验证资料可参照《无源植入性医疗器械稳定性研究指导原则》提供,一般包括器械自身性能测试和包装系统性能测试两个方面。对于不同包装形式的产品需考虑分别提供验证资料。
货架有效期验证试验通常可分为加速稳定性试验和实时稳定性试验两类。在进行实时老化试验设计时,注册申请人需根据产品的实际运输和储存条件确定适当的温度、湿度、光照等条件。在进行加速稳定性试验时,注册申请人需根据产品的材料特性确定适当的试验条件,并分析开展加速稳定性试验的合理性。
注册申请人需提供疝补片使用稳定性相关的研究资料、文献资料等支持性资料,证明产品的性能功能在植入人体后持续满足使用要求。
10.其他资料
对于符合《免于临床评价医疗器械目录》(以下简称《目录》)下分类编码为13-09-04的疝修补补片,注册申请人需按照《列入免于临床评价医疗器械目录产品对比说明技术指导原则》提交申报产品相关信息与《目录》所述内容的对比资料和申报产品与已获准境内注册的《目录》中医疗器械的对比说明。申报产品与已获准境内注册产品的对比要点可参考附录一表2。
(四)临床评价资料
对于不属于《目录》描述范围的产品,注册申请人需按照《医疗器械临床评价技术指导原则》及相关文件要求提交临床评价资料。
注册申请人可参照《决策是否开展医疗器械临床试验技术指导原则》决策是否需要开展临床试验,若申报产品开展临床试验,则需严格按照《医疗器械临床试验质量管理规范》进行临床试验,并提交完整的临床试验资料。临床试验的设计可参考《医疗器械临床试验设计指导原则》、《疝修补补片临床试验指导原则》。注册申请人如有境外临床试验数据,可参照《接受医疗器械境外临床试验数据技术指导原则》的要求提交相关资料。
(五)产品说明书和标签样稿
1.产品说明书和标签样稿需符合《医疗器械说明书和标签管理规定》要求,还需符合YY/T 0640《无源外科植入物 通用要求》中的相关规定。
2.性能特征描述需以注册申请人提交的研究资料及产品技术要求为准。
3.适用范围及禁忌证描述应以注册申请人提交的研究资料及临床评价资料为准。对于不能置于腹腔内的疝修补补片,需在禁忌证或警示部分予以说明。
禁忌证举例:疝修补补片不能用于妊娠患者、婴幼儿及生长发育期儿童;不能用于未处理的感染部位等。
4.对于具有一定程度上降低自身与腹腔内组织粘连设计的腹腔内置疝补片,说明书中宜客观描述,不得使用“防粘连”等绝对化表述。
三、参考文献
[1]《医疗器械监督管理条例》[Z].
[2]《医疗器械注册与备案管理办法》(国家市场监督管理总局令第47号)[Z].
[3]《医疗器械说明书和标签管理规定》(原国家食品药品监督管理总局令第6号)[Z].
[4]《医疗器械通用名称命名指导原则》(国家药品监督管理局通告2019年第99号)[Z].
[5]《关于公布医疗器械注册申报资料要求和批准证明文件格式的公告》[Z].
[6]《医疗器械分类目录》[Z].
[7]《医疗器械注册单元划分指导原则》[Z].
[8]《医疗器械产品技术要求编写指导原则》[Z].
[9]GB/T 16886,医疗器械生物学评价 系列标准[S].
[10]GB/T 14233.1,医用输液、输血、注射器具检验方法 第1部分:化学分析方法 [S].
[11]GB/T 14233.2,医用输液、输血、注射器具检验方法 第2部分:生物学试验方法 [S].
[12]《中华人民共和国药典》2020版[S].
[13]YY/T 0316,医疗器械 风险管理对医疗器械的应用 [S].
[14]YY/T 0640,无源外科植入物 通用要求 [S].
[15]YY 0167,非吸收性外科缝线 [S].
[16]YY 1116,可吸收性外科缝线 [S].
[17]YY/T 0661,外科植入物用聚(L-乳酸)树脂的标准规范 [S].
[18]YY/T 0510,外科植入物用无定形聚丙交酯树脂和丙交酯-乙交酯共聚树脂 [S].
[19]FDA-Guidance for the Preparation of a Premarket Notification Application for a Surgical Mesh,1999.3[Z].
[20]《无源植入性医疗器械产品注册申报资料指导原则》[Z].
[21]《医疗器械动物试验研究注册审查指导原则》系列指导原则[Z].
[22]《无源植入性医疗器械货架有效期注册申报资料指导原则(2017年修订版)》[Z].
[23]《同种异体植入性医疗器械病毒灭活工艺验证技术审查指导原则》[Z].
[24] YY/T1788,外科植入物 动物源性补片类产品通用要求》 [S].
[25] YY/T 1814,外科植入物 合成不可吸收补片 疝修补补片 [S].
四、编写单位
本指导原则由国家药品监督管理局医疗器械技术审评中心编写并负责解释。
附录一
表1 疝补片基本信息
|
型号规格 |
形状 |
长度 (mm) |
宽度 (mm) |
厚度 (mm) |
孔尺寸 (mm) |
网孔密度 (个/mm2) |
单位面积重量 (g/m2) |
|
XXXX |
|
|
|
|
|
|
|
表2 申报产品与已获准境内注册产品的对比要点
|
与目录中已获境内注册产品对比项目 |
具体关注要求项目 |
|
基本原理(工作原理/作用机理) |
明确瘢痕化修复或组织重塑再生修复。 |
|
结构组成 |
形状;单层/多层;是否带有工具配件;是否还有特殊部件(缝合环、缝线等)。 |
|
制造材料 |
各部件组成材料。 |
|
性能要求 |
1.机械性能:拉伸伸长率可与人体相应组织的相关机械性能进行对比,若存在差异则与市售产品进行对比研究,证明两者等同性;单位面积重量、孔尺寸/孔面积、网孔密度/网孔比例(含有编织网孔的补片)、孔隙率(含有微孔结构设计的补片)一般宜与市售产品相当;撕裂强度(仅适用于裤形补片)、缝合强度、连接强度等项目宜不差于已上市产品。 2.尺寸:相同修复机理、相同适用范围、类似结构的型号进行对比,不建议超出境内已批准产品的尺寸范围,如超出尺寸范围建议提供临床评价资料。 |
|
灭菌/消毒方式 |
需对比分析。 |
|
适用范围 |
不超出豁免目录及对比市售产品的范围。 |
|
使用方法 |
开放手术/腔镜手术不超出已上市产品范围。 |
|
对比项目可根据实际情况予以增加。 |
结合腹腔内置补片及重塑再生补片的动物试验,对申报产品与市售产品进行等同性分析。 |


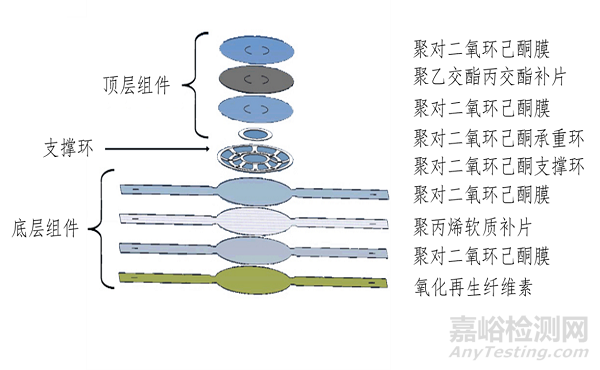
图1 图示举例一

图2 图示举例二
附录二
|
序号 |
建议的性能研究项目 |
是否建议列入产品技术要求 |
是否需以研究资料形式提供 |
备注 |
|
|
一般性要求 |
|||||
|
|
外观 |
是 |
否 |
/ |
|
|
|
尺寸[长度、宽度、厚度、孔尺寸/孔面积、网孔密度/网孔比例(含有编织网孔的补片)、孔隙率(含有微孔结构设计的补片)、特殊形状或结构所涉及的其他尺寸及允差(包括上限及下限)] |
是 |
是 |
/ |
|
|
|
单位面积重量—上限及下限 |
是 |
是 |
适用于合成材料编织补片。 |
|
|
|
对于染色的补片,应制定褪色试验要求 |
是 |
否 |
/ |
|
|
|
无菌 |
是 |
否 |
/ |
|
|
|
细菌内毒素 |
是 |
否 |
/ |
|
|
机械性能要求 |
|||||
|
|
拉伸强度—下限 |
是 |
是 |
若材料设计、编织工艺等原因导致补片具有各向异性,分别制定纵向、横向拉伸强度。 |
|
|
|
拉伸伸长率—上限及下限 |
是 |
是 |
若材料设计、编织工艺等原因导致补片具有各向异性,分别制定纵向、横向拉伸伸长率;建议制定人体生理条件可能受到的最大腹壁拉力下的拉伸伸长率,关于拉伸伸长率的接受标准,综合人体天然腹壁的伸长率情况及疝补片产品的实测数据进行指标的限定。 |
|
|
|
顶破强度—下限 |
是 |
是 |
/ |
|
|
|
顶破伸长率—上限及下限 |
否 |
是 |
|
|
|
|
缝合强度—下限 |
是 |
是 |
/ |
|
|
|
连接强度—下限 |
是 |
是 |
若是多层结构或由不同部件连接的产品,要求制定连接强度。 |
|
|
|
撕裂强度—下限 |
是 |
是 |
仅适用于存在贯穿开口的补片。 图示举例:
|
|
|
|
缝合孔内向撕裂力 |
是 |
是 |
适用于缝合时易发生受力不均情况的生物材料类、可吸收类膜状补片。 |
|
|
|
可展开性 |
否 |
是 |
适用于腔镜手术下使用、有一定延展性要求的补片,进行模拟使用性能评价。 |
|
|
|
刚度 |
否 |
是 |
一定程度上评价在人体组织中的顺应性(刚度/柔度)。 |
|
|
化学性能要求—表征相关 |
|||||
|
|
人工合成材料的红外或核磁表征 |
否 |
是 |
材料表征参考相关国行标。 |
|
|
|
人工合成的单一材料组成产品的特性粘数或平均分子量、分子量分布 |
不可降解材料 |
否 |
是 |
若生产工艺对材料无影响,可用不可降解材料的原材料质量控制标准及报告代替研究资料。 |
|
可降解材料 |
是 |
是 |
采用终产品测试。 |
||
|
|
人工合成的复合材料组成产品中可吸收部分的特性粘数或平均分子量、分子量分布 |
是 |
是 |
采用终产品测试。 |
|
|
|
旋光度 |
否 |
是 |
适用于聚乳酸等具有旋光性的高分子材料。 |
|
|
|
可降解共聚物中各单体形成结构单元的摩尔分数 |
否 |
是 |
研究资料中分析终产品与原材料的差异。 |
|
|
化学性能要求—杂质控制相关 |
|||||
|
|
酸碱度—上限 |
是 |
否 |
/ |
|
|
|
重金属总量、有害微量元素—上限 |
是 |
否 |
参考相关国行标、产品材料特性、生产工艺等选择适用的元素种类。 |
|
|
|
成品中有害小分子物质残留量—上限 |
是 |
否 |
结合产品生产工艺、有害小分子物质的人体可耐受水平综合考虑。 |
|
|
|
对于人工合成的可吸收材料(如聚乳酸等)制成的产品,单体残留、催化剂残留、溶剂残留、水分残留—上限 |
是 |
否 |
/ |
|
|
|
对人工合成的不可吸收材料,要求还原物质、蒸发残渣、紫外吸光度—上限 |
是 |
否 |
选择其中适用的项目进行要求。 |
|
|
|
对提纯的天然高分子材料如胶原,要求纯度及含量 |
是 |
是 |
/ |
|
|
|
提纯的天然高分子材料及脱细胞基质材料等制成的产品,终产品中有害大分子物质的残留量要求等 |
否 |
是 |
引起免疫原性的成分,如杂蛋白、DNA等,不列入产品技术要求。 |
|
|
|
经EO灭菌产品的EO残留量—上限 |
是 |
否 |
/ |
|
|
其他 |
|||||
|
|
若疝修补补片带有工具等附件,还需制定除补片外其它附件相关的项目要求。 |
视具体项目要求而定。 |
视具体项目要求而定。 |
/ |
|
|
|
含有合成可降解/可吸收材料成分产品的降解性能 |
否 |
是 |
/ |
|

来源:中国器审


