您当前的位置:检测资讯 > 法规标准
嘉峪检测网 2022-07-11 23:15
[摘要] 本文梳理了美国FDA非处方药专论制度的发展背景、历程、主要内容和改革现状,对美国非处方药上市程序、非处方药专论制定及监管法规进行分析与解读,为我国非处方药分类注册管理工作提供参考。
非处方药( over-the-counter,OTC) 是指不需要凭医生处方,消费者即可自行购买和使用的药品,具有治疗目标明确、疗效确切、安全性好、使用方便等特点。我国自 2000 年开始实施处方药、非处方药分类管理,主要对药品上市后的环节进行管理[1-2]。对于上市前审批环节,我国OTC药物的审批程序和技术要求体系与处方药基本相同,OTC上市申请有2种方式: ① 在药物注册申请的同时附加非处方药申请。② 由已上市的处方药经评价后转换为非处方药的方式。另外非处方药均需要核准说明书,比处方药的审批流程更加严格。美国实行药品分类管理的时间较早,制度体系也相对完善,在OTC上市注册和管理上积累了丰富的经验。非处方药在美国除了常规的药物上市申请程序,还可以通过简化注册为非处方药的专论程序。美国OTC专制度自1972 年开始实施,其发展历程较具有代表性。本文通过对美国OTC专论制度的建立和发展及OTC专论的主要内容、实施和改革情况进行梳理分析,为我国OTC分类注册管理工作提供参考。
1、 美国OTC专论制度的建立和发展
OTC在美国市场上市有2种监管途径,分别为药物申请程序( drug application process) 和非处方药专论程序(OTC drug monograph process)[3]。1972年美国FDA建立OTC药物审评制度,以评估当时市场上数十万 OTC 药品的安全性和有效性[4]。由于OTC药品种类繁多,美国 FDA 采用按治疗类别分组的方式进行分类审评,发布OTC专论( OTC专著,OTC monograph) 。OTC专论是每个治疗类别的“规则手册”( rule book) ,内容包含活性成分、剂型、规格、说明书及对某些治疗类别的包装或检测要求[5]。根据该手册,OTC药物通常确认是安全有效的,若符合既定适应证下OTC专论的要求和其他相应法规,无需新药申请流程和美国FDA上市前批准,备案后即可销售。根据 OTC专论程序上市销售的非处方药产品称为OTC专论药物。目前美国OTC专论包含约800种有效成分,涉及1400多种不同用途,授权超过100 000种药物。
2020年3月之前,OTC专论的增加、删除或更改只能通过繁琐的三阶段公共规则制定程序( notice-and-comment rulemaking) ,导致美国 FDA 在处理重大安全问题时无法快速对OTC专论进行修订。2020年3月27日,美国总统签署了748 号法案( H. R. 748) 《冠状病毒援助、救济和经济安全法》( the Coronavirus Aid,Relief,and Economic SecurityAct,CARES) ,其中包括 OTC 专论改革的法律规定,旨在提高OTC药品审评流程的效率、及时性和可预见性,被认为是OTC专论药物开发和审评过程的现代化改革[6]。
2、 美国 OTC 专论制定的程序
纳入OTC专论的药品遴选审评依照美国联邦法规第21篇“食品与药品”条款( Code of FederalRegulations,Title 21 Food and Drugs,21CFR) 第 330部分“通常公认为安全有效的非处方药( over-the-counter human drugs which are generally recognized assafe and effective and not misbranded) ”进行,包含两部分[7]。其中,A 部分为一般条款( subpart a-generalprovisions) ,内容有4条,分别是330. 1 遴选安全有效非处方药的基本条件、330. 2 妊娠期使用警告、330. 3 固体口服剂型药物产品的识别码标记、330. 5药物类别; B 部分为行政管理程序( subpart B: admin-istrative procedures) ,内容有 6 条,分别是 330. 10 OTC药物遴选分类和 OTC 专论建立的程序、330. 11 新药上市申请( NDA) 偏离适用的专论、330. 12 在之前药物疗效研究( DESI) 中已审查的 OTC 状态、330. 13根据 OTC 审评建议以 OTC 上市使用的条件、330. 14将药物分类为公认安全有效 OTC 药物的标准和程序、330. 15 FDA 审评工作时限表、申请范围和安全性有效性数据提交。
OTC 专论建立的程序在 21CFR 330. 10 条款中包含 12 个程序,分别为组建审评专家委员会[8]、数据递交和审查、审评专家委员会审议、安全有效性和说明书标准、审评专家委员会提交报告、拟纳入专论初稿、审评专家委员会提交完整报告、专论意见稿、专论正式稿、行政记录、法院上诉、专论修订。OTC 专论审评共有 3 个阶段状态。第 1 阶段为拟纳入专论初稿( advanced notice of proposed rulemaking,ANPR) ,由审评专家委员会审议后认可其安全性和有效性,并出具审评声明和推荐的说明书,形成报告提交给局长,并征求意见。审评专家委员会一般将遴选药品分成 3 类: Ⅰ类为对声明的适应证用途公认是安全有效的 ( generally recognized as safe and effective,GRASE) ,被称为GRASE药品,经进一步审议后可纳入 OTC 专论。Ⅱ类为对于声明的适应证用途来说不能被公认为安全有效的( not generally recog-nized as safe and effective,NGRASE) ,不能作为 OTC专论产品进行管理。Ⅲ类为安全有效性证据不足的,暂时不能进行分类[9]。第 2 阶段为专论意见稿( tentative final monograph,TFM) ,美国 FDA 基于专家委员会对成分的审查和公众意见及数据资料等对药物活性成分的审查,形成TFM 发布拟认定为安全有效且不含商标的OTC产品,并进行为期60d的公示。第3 阶段为专论正式稿( final monograph,FM) ,OTC 专论正式稿中OTC成分及适应证是被认定安全有效的,最终在美国联邦法规( CFR) 中建立条款。
目前的OTC专论正式稿收录在21CFR第 331 ~358 部分,为OTC专论药物提供合法上市的资格。在21CFR 310. 545 中列出了NGRASE 活性成分,即非OTC专论的活性成分。21CFR 310. 519 ~ 548 中所列的成分是需要新药审批的,也不是OTC专论的活性成分。部分OTC产品的TFM被修改多次,增加了新适应证或用途,删除了一些转移到其他专论中的成分,或者纳入了新的数据和信息而引发变化,导致整个专论最终没有完成出版。OTC专论可根据需要通过提交申请进行修订。在TFM公示期结束后,OTC专论正式稿发布前,若提交新的数据和信息将被视为对专论的修订,并且需在OTC专论正式稿发布后才会被考虑。
在美国 FDA 网站上,列出了OTC产品和活性成分参考,提供了按活性成分字母排序、按专论 /类别字母顺序和总表格3个版本,以方便快速查询[10]。
3、美国 OTC 的上市申请
美国OTC上市注册申请有OTC专论程序( OTCdrug monograph process,21CFR 330 ) 和NDA程序( 21CFR 314)[9],既可以递交OTC专论申请,也可以递交 505( b) ( 1) ,505 ( b) ( 2) ,( 505) ( j) 申请。无论哪一种申请程序,OTC 药品必须符合安全性和有效性明确的标准。尽管2 种申请程序会有不同的要求,但2种申请程序和其他申请程序相比,并没有要求更高的安全有效性标准。在这2种申请程序下,产品都必须按照21CFR 210中定义的现行良好生产规范( current Good Manufacturing Practices,cGMP)进行生产,并且必须符合 21CFR 201. Subpart C中的说明书内容和格式要求[11]。
OTC 专论程序是基于专论中包含的GRASE 活性成分,与基于药物处方的 NDA 申请不同。在活性成分、适应证、说明书等方面均符合OTC专论申请的非处方药,且符合cGMP 要求,不需要经美国FDA特别批准就可以上市。例如,如果OTC防晒药物产品包含符合OTC防晒专论中认可的配方、说明书和检测的标准,即可以合法上市销售。有偏离或不符合OTC专论要求的非处方药,在上市前需要审批,可通过NDA申请( 21CFR 330. 11) 或公民请愿( citizen petition,21 CFR10. 30) 途径进行。提交公民请愿申请不需要支 付《处方药使用者费用法》( Prescription Drug User Fee Act,PDUFA) 规定的费用,内容是公开的。通过NDA申请需要支付PDUFA规定的费用,其内容是保密的,且根据PDUFA规定,有进度时限要求,批准后可获得市场专营期。
对于在OTC专论制度施行前已在美国上市的,或尚未在美国上市的OTC药品,在 21CFR 330. 14“OTC药物分类的其他标准和程序”中规定,如果要考虑纳入 OTC 专论进行管理,必须满足 2 个条件:① 在市场上以OTC药品来销售。如果是在其他国家或地区销售某一类OTC药,必须仅在药店出售,有明确证据表明其活性成分、用法用量等所呈现的毒性或其他潜在危害都是有限的。② 在同一国家或地区至少连续销售5年,且数量达到一定规模。如果一个国家连续5年上市后的数据不充分,可能需要补充1个或更多国家上市后的数据。
如果将现有的NDA 处方药整体转变为OTC,不变化剂型和给药途径,可以递交有效性的补充申请。如果是将现有的处方药部分适应证转变为OTC,需要递交 505( b) ( 1) 申请。如果拟上市新的OTC产品,其活性成分、适应证、剂型之前都没有以OTC上市,也需要通过递交 505( b) ( 1) 或 505( b) ( 2) 申请。一般情况下,具有原研地位的参照药物( referencelisted drug,RLD) 还在市场上销售且已转为 OTC 的,相应仿制药( abbreviated new drug application,ANDA)或改良药转为OTC; RLD 是处方药的,相应 ANDA还是处方药。一般不允许同一种活性成分同时在市场上存在处方药和 OTC 状态,除非两者之间存在有意义的差异,处方药只有在执业医师的监督下使用才安全。
对于含有2个或2个以上成分的非处方药,在21CFR 330. 10( a) ( 4) ( iv) 的组方规则中规定,每种活性成分必须均支持适应证所声称的疗效; 活性成分的复方组合不降低任何单个活性成分的安全有效性; 复方组合应具有组合治疗的合理性。
当对产品成分和适应证进行OTC审评,但是未形成专论正式稿时,此类产品可以上市,但是按照21CFR 330. 10,此类产品上市是有风险的,拟定的GRASE条件可能会变化,美国FDA也有可能不接受专家委员会的建议,那么产品则需要进行重新标签、召回或其他监管行动。
OTC 药物的 NDA 申请和 OTC 专论要求不符的情况,在NDA偏离适用专论条款 21CFR 330. 11 指出,应采用 21CFR 314. 50中要求的格式,还应包含一份声明,说明产品除了申请中提出的差异,均符合适用专论的其他所有条件。
4、美国 CARES 法案下 OTC 专论制度的改革
4. 1 OTC 专论制度的改革历程
在美国OTC药物一直是满足大众日常健康需求的有效且低成本的药物,在医疗体系中扮演着越来越重要的角色。在美国市场上销售的OTC药物大多数是通过OTC专论制度上市使用的。OTC专论在一定程度上有利于该类产品顺利上市使用,企业不仅可以快速上市简单仿制类产品,还可以根据市场情况在口味、剂型等方面进行部分改良创新,从而更好地满足了消费者多样化的产品需求,也有利于减轻行业的监管负担。然而,建立或修改OTC专论的法规繁琐,规则制定的步骤复杂; 而美国FDA又缺乏足够的经费和资源用于OTC专论的制定。目前仍有大量专论申请审评被长时间搁置,未能确定。OTC专论体系的更新缺乏及时性和灵活性,特别是在安全性方面,许多专论活性成分安全标签变更尚未进行,科学认知的不断发展和市场条件的不断变化给OTC专论制度带来挑战。为了更好地为患者、消费者和行业服务,美国FDA对OTC专论制度进行改革,以简化审评活动[12]。OTC专论改革的目标和需解决的问题包括: 通过用行政命令代替规则制定来改善OTC专论制定的流程; 提高审评效率、及时性和可预见性,促进创新发展; 建立可快速更新安全性内容的流程,完成待定的 OTC 专论; 提供用以支持OTC专论工作的经费支持[13]。
2015 年美国FDA开始与业界探讨改革OTC专论制度并公开征求意见,于 2017年6月将最终提议递交美国国会。2019年美国国会参议院提出的269 号《OTC专论创新改革法案》( Over-the-counter Monograph Safety,Innovation,and ReformAct of 2019) 获得全面批准,此项法案在OTC 专论制度上进行了重大改革: ① 以行政命令方式确定OTC专论的正式稿,取代以往联邦法规发布形式,这使得专论流程制定和发布更高效。② 建立OTC专论药物使用者费用计划( OTC monograph drug userfee program,OMUFA) ,该计划从 2021 财政年开始收取费用以支持专论的审评及OTC药物相关的检查等工作。③ 明确OTC产品专利权,将授权对符合条件的OTC 进行为期18个月的市场专营期。
2020 年正值新型冠状病毒肺炎疫情期间,美国国会于 3 月 27 日紧急通过CARES法案实施改革,推进OTC专论药物现代化监管方式。CARES法案对OTC专论制定、修订补充的行政命令程序进行了改革,还赋予美国FDA评估和收取专门用于 OTC专论药物工作的 OMUFA 费用的权力,以帮助该机构及时开展重要的监管活动,助力更多创新性OTC专论药物上市使用。CARES 法案实施后,新OTC专论制度体系被认为响应程度更高、更为透明,同时可持续确保相关药品的安全性与有效性。
4.2 CARES 法案之后的OTC药物审评
CARES法案之后OTC药物审评不变的内容包括: OTC活性成分的审查、按治疗类别分组的有效成分、GRASE的确定、符合OTC专论和其他适用要求的药物可在未经美国FDA批准的情况下进行销售、程序包括公开征求公众意见。新法案在行政命令程序( administra-tive order process) 、OTC 专论命令请求( OTC mono-graph order request,OMOR) 、解决现有OTC专论药物积压申请( 包括以前接受过 TFM 和ANPR 的药物、剂型微小变更的流程) 、某些OTC专论药物市场专有期、OTC专论使用费、正式会议等方面进行了改革。
用于代替规则制定过程的行政命令流程更快速。行政命令程序可以添加、删除或更改OTC专论的GRASE 条件,可以由行业或美国FDA发起。对于行业发起的申请( industry-initiated order) 分为第1级和第2级,可提交OMOR 以请求美国FDA启动行政命令处理,并规定了相应的审评时间( 见表1) 。
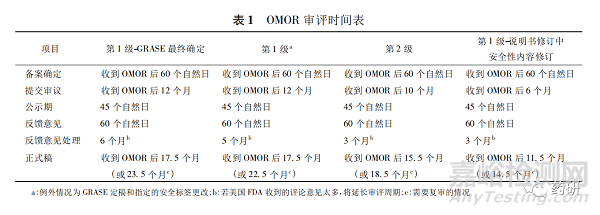
4.3 CARES 法案之后的OTC专论修订
新法案实施后,若OTC专论存在安全性方面的问题,美国FDA可以通过启动行政命令程序来及时修订处理。例如,美国FDA可以更改药品说明书标签 ( drugfacts label,DFL) 中包含的标签语言; 美国FDA可以发布某些具有包装要求的行政命令,以鼓励按照说明书标签使用。在特定情况下,美国FDA可启用加急行政命令( expedited administrative orders) 。
4.4 CARES 法案之后的OTC专论工作计划
美国FDA在2021年10月1日前开始发布第一个工作计划,随后工作计划的发布频率不低于每年1次。每年美国FDA都会发布1份非约束性的OTC专论药物问题清单,并计划在未来3年内解决这些问题,包括安全标签的更改。对于需要提交数据的问题,美国 FDA 将在其上注明提交日期。
美国FDA在2021财年向公众开放OTC Mono-graphs@ FDA数据库,公众能够在此搜索查找提议和最终的行政命令,增加、删除或更改OTC药物专论的条件; 同时公众也可在此对拟提议的行政命令提出意见[12]。
5、对我国 OTC 分类注册管理的启示
对我国OTC分类注册管理的启示非处方药OTC专论在越来越多的国家或地区的监管实践中被运用,该项举措既有利于节约审评资源、提高监管效率、加快 OTC药物上市速度,也可以满足公众对于OTC药物的需求。美国对采用专论程序上市的产品不进行传统意义上的审评审批,看似放松了对这类产品的注册监管,弱化了上市准入环节的风险管控,而事实并非如此,OTC专论制定过程本身就是风险管控的过程。从美国OTC专论制度的建立发展和近期的改革举措可以看出,OTC上市的注册管理是整个OTC药品管理制度体系的组成部分,OTC专论制度的实施必须配合完善的药品全生命周期风险管理制度和措施。
我国2020年颁布的《药品注册管理办法》( 以下简称《办法》) 首次明确了国家药品监督管理局药品审评中心( 以下简称药品审评中心) 制定符合OTC 药品特点的上市工作程序和技术指导原则,是对OTC药品审评管理的一大进步,将有利于促进更多的OTC上市,同时有利于加快OTC上市速度。《办法》第十五条中指出“处方药和非处方药实行分类注册和转换管理。药品审评中心根据OTC的特点,制定OTC上市注册相关技术指导原则和程序,并向社会公布。药品评价中心制定处方药和OTC上市后转换相关技术要求和程序,并向社会公布”。《办法》第三十六条指出有符合以下 4 种情形之一的,可以直接提出OTC上市许可申请: 境内已有相同活性成分、适应证( 或者功能主治) 、剂型、规格的OTC上市的药品; 经国家药品监督管理局确定的OTC改变剂型或者规格,但不改变适应证( 或者功能主治) 、给药剂量以及给药途径的药品; 使用国家药品监督管理局确定的OTC的活性成分组成的新复方制剂; 其他直接申报OTC上市许可的情形。另外还规定,药品审评中心根据药品注册申报资料、核查结果、检验结果等,对药品的安全性、有效性和质量可控性等进行综合审评,OTC还应当转药品评价中心进行OTC适宜性审查。OTC的药品注册证书还应当注明OTC类别。OTC适宜性审核时限为30d[14]。2020年7月药品审评中心公开征求《化学药品非处方药上市注册技术指导原则( 征求意见稿) 》意见,基于我国OTC注册申报特点,制定OTC上市许可申请的技术要求,执行与处方药上市许可申请一致的原则。该指导原则明确指出仅适用于化学药品类OTC[15]。
我国的OTC产品既有化学药品,也有中药。目前我国OTC约5065个品种,其中化学药品1115个品种,中药3950个品种,中药品种远远多于化学药品。在美国销售的OTC约有300000 种[9],且很少涉及中药,品种数量是我国的近 60 倍。随着我国改革的深入发展,我国已成为全球最大的医药消费市场之一,近年来我国OTC药物公众需求的不断增加,OTC市场规模也在持续增长,但药品审评资源非常有限,OTC注册管理体系尚未完善。在药物审评审批制度改革中,我国正处于仿制药一致性评价的关键时期[16],按照处方药的工作程序和技术要求,制约着OTC注册申报和审评审批进度,OTC仿制药的参比制剂难以确定,由于审评资源和监管资源有限,增加了审评的压力,加重了行政审批的资源负担。
OTC在促进公众健康方面发挥了重要作用,且有助于节约医疗成本、减轻医疗压力,具有较大的潜在社会价值。我国应进一步完善OTC管理的法规体系、注册路径和审评程序,完善配套政策,合理配置审评资源。例如,探索适合我国现阶段药品审评审批改革发展要求的OTC专论制度; 完善OTC药物从研发、审评到上市后管理的全生命周期监管法规要求; 设置独立的OTC政策研究和审评及上市后的监管部门; 探索建设区别于处方药审评的OTC药物尤其是仿制药申报的审评程序和技术要求等,为OTC的上市使用提供更高效的途径,以促进我国OTC的研发和使用,助力实现健康中国的战略目标。

来源:中国新药杂志


