您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2022-04-24 22:06
生物制品作为大分子药物,结构和功能相对复杂,其药效又多与其生物活性直接相关。基于生物制品要优质活性的特性,生物制品多无法进行终端灭菌,因此对其生产过程的控制更为严格,工艺中的每一步骤均需严格控制微生物的污染及内毒素的残留。并且需要严格执行批间及批内的清洁程序,以达到残留蛋白的完全清除。既要保证无宿主蛋白的残留,又要保证无目的蛋白的残留,最大限度保证患者的用药安全。
生物制品的清洁验证本质是一种工艺验证,是将清洁方法作为一种重要的工艺步骤来看待,对于全对药品全生命周期的风险管理,保证清洁方法的持续有效,并随着生产工艺的变化清洁工艺或者说清洁方法也会随之发生一些变化。因此应定期评估清洁工艺的有效性。
清洁工艺的风险评估,风险评估方法作为有效控制药品质量的工具,已广泛的应用于各个制药领域,清洁验证的活动本身从重要性和复杂性两个方面,均有强烈的风险评估的需求,同样也是监管部门的要求。
风险识别
识别来自环境、设备、方法、化学和微生物实体以及人员的危害。这些危害可能会对清洁后的最终残留物产生影响,因此被认为是风险。
风险分析
进一步分析这些风险,以更好地理解这个过程,然后根据它们对清洁的影响进行优先排序。在此阶段,通过设计评审、数据评审和研究来增加工艺知识,以了解工艺参数、设备、环境和人员之间的相互作用。
风险评估
对风险进行评估,识别额外的控制措施以降低风险 ( 风险降低 ) 或接受风险 ( 风险接受 )。
风险控制
在风险控制过程中,对可接受的风险做出最终决定,并完成控制策略,以确保减轻的设计、程序和技术控制得以实施并保持到位。此控制策略正式传达给利益相关者。
风险回顾
应定期或当重大或新的危害出现时,如新产品的引入,重大事件或活动发生后,进行风险回顾。
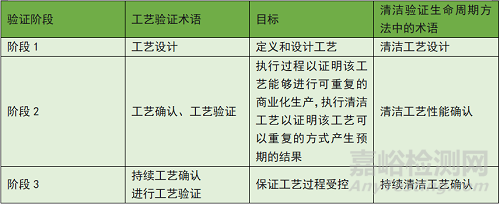
清洁验证阶段及目标
清洁验证核心要素之一是清洁工艺的开发,基于产品特性开发的清洁工艺是能够保证产品免于各种污染,在清洁工艺开发的过程中,需要对清洁剂种类及浓度、清洗的方法、持续时间、温度等重要的工艺参数进行全面的开发,并且具有足够的操作空间来保证清洁的效果,即使是在清洁的设备、人员、清洁剂发生一定的波动的时候,也能保证清洁的效果。
由于清洁工艺的开发本身涉及到被清洁设备的材质、残留物的种类,残留的类型、脏设备的保留时间 (DHT)、ATCT 等多元输入参数的相互作用,各种元素又会相互作用,因此采用实验设计的方法进行清洁工艺的方法开发是一种合理的方式。
通过实验设计的方法,摸索出清洁工艺的操作空间,以便于在正式的清洁工艺验证执行过程中,能够得到顺利的开展。例如鉴于生物制品生产的特性,在上游生产的过程中,物料的种类是非常复杂的产出物也是很难进行完整定义其残留量,又因为缓冲液体系和培养基配制的不同的工艺段所带来的残留,允许的限度和残留的物质的不同也会导致不同的清洁方法,由此带来的清洁工艺的开发会是多样的,而且需要并行考虑的。
清洁工艺开发结束以后,需要进入到正式商业化生产的车间里开展具体的清洁工艺转移,由于生物制品生产工艺的复杂性,实验室中开发的清洁工艺需要准确无误的转移到生产体系中,清洁工艺的技术转移就会显得特别重要,企业应当如同工艺转移一样,需要建立清洁工艺的技术转移模式保证实验室阶段开发出来的清洁工艺,能够有效的转移。现行的各国法规基本要求清洁验证需要至少和产品上市时同步完成,并在后续的生产过程中得到持续有效的控制,保证其验证状态。
生物制品的清洁工艺开发生物制品生产和清洁过程中有许多特殊的方面:清洁方法相似,如纯化水冲洗、碱洗、注射用水冲洗、SIP 等。不同生物工艺的清洁方法也可能是相似的。
法规中对生物制品的某些工艺的物料规定了必须专用,如层析填料、超滤和纳滤的滤膜,而一般的生物制品企业基于产品价值和风险考虑,很少有重复使用耗材的习惯,这种情况,需要进行考虑清洁验证的工艺设备 ( 共线部分 ) 可能很少,特别是在一次性物品大量使用的厂房中。生物制品生产过程中作为主要药物成分的蛋白质非常容易降解,导致生物制品的清洁验证时检测药物活性成分的方法可能不适用,但是降解后的物质,可能依然具有活性(如致敏性 )。生物制品在不同工艺段的污染物可能有很大的不同,因此不能设计统一的限度标准和测试方法
清洁取样方法清洁验证的取样方法通常为擦拭法和淋洗水取样两种方式,目视检测是必须的,因为目视检测都无法通过的话,采用理化检测的必要性就不存在了。通常建议能够用擦拭法的地方尽可能的使用擦拭法,基于某些特殊情况,PDA 技术报告 49 中也提出了豁免擦拭取样的几个基本原则:
1、不能进行擦拭取样的设备和能够进行擦拭取样的设备具有相同的材质;
2、难以进行擦拭取样的设备暴露在与能够进行擦拭取样的设备表面相同残留和条件下;
3、采用与能够进行擦拭取样的设备相同的清洁程序对难以接触的设备表面进行清洁( 即,同样的清洁剂和同样的温度 );
4、管道系统清洁的机械力与使用喷淋球清洁的罐体相比应更大 ( 例如,湍流 );
5、相比于罐,在清洗管道系统时保证完全灌满液体;
6、冲淋取样适当的解决了表面交叉污染的问题。
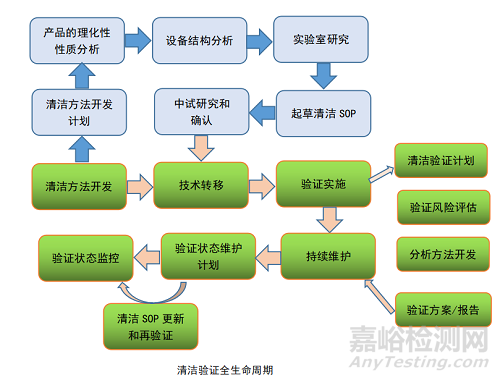
清洁工艺的持续确认阶段,清洁工艺持续监控用来确保清洁程序在一个受控的状态下运行,第三阶段主要包括如下几个方面:
一、 进行中的清洁监控
通过工艺监控,可以监测到一些未列入计划内的偏离事件。来自工艺监控的数据应趋向于清洁方法性能的变化。监控程序应基于风险并注意通过清洁验证来建立危害和置信度。监控程序可以是清洁工艺性能确认期间使用的测试的子集,应包括取样计划,并应列出所有要使用的分析方法。
二、定期审查
作为验证生命周期的一部分,对清洁工艺状态进行全面评估。审查的目的是证明清洁工艺持续保持在经过验证的控制状态中,如果发现清洁工艺过程失控则定期检查的结果可能包括有关工艺改进或重新验证的建议。
三、产品更换程序 (PCO)
PCO 程序应该是在位的,基于风险的方法,结合历史性能数据,基于这些来运行产品更换程序。
四、额外控制
经过验证的清洁工艺将按照变更控制程序进行维护。
制定了预防性维护计划使设备保持运行状态。此外,代表清洗工艺失败的意外事件将被记录为偏差。例如,在按照已批准的程序进行重新清洁之前,必须文件化记录每一次不符合接受标准的人工清洁实践。该程序应指出一项调查要求,即跟踪所有性质相似的故障并得出趋势,以进一步确定根本原因,以便采取适当的纠正和预防措施,而不仅仅是重复清洁直到满足所有接受标准。研究这些偏差以评估可能的原因和纠正措施,以使清洁工艺回到正常控制状态。预防性维护和校准程序可确保设备和仪器正确运行并处于已校准状态。
清洁验证在生物制药生产过程中,以生产设备为基础进行的清洁活动,在降低产品污染方面扮演着重要的角色。清洁验证证明清洁工艺能够充分并且始终如一的从清洗的设备 / 系统上去除产品残留、工艺残留和环境污染,以保证产品的安全。清洁工艺的开发要符合产品的自有特性,结合生产工艺,选取与工艺路线匹配的设备及原材料,将研发过程和生产过程很好的衔接在一起,是产品的商业化生产及后续的验证维护的基础。

来源:蒲公英Biopharma


