您当前的位置:检测资讯 > 法规标准
嘉峪检测网 2022-04-13 05:10
在现有质量管理体系下,如何升级为满足MDR要求的质量管理体系?
以有源设备为例
MDR下规定了哪些过程重要的过程
1. 识别GSPRs所适应条款;
2. 建立风险管理体系(附录I第一章第3节)
3. 进行临床评估(条款61,附录XIV,包括上市后临床跟踪)。另:临床研究
4. 建立、维护、存储CE技术文档(附录II和附录III)
5. 申请符合性评估,如何满足符合性评估要求的过程应形成指导性文件
6. 与公告机构、监管机构、其他经济运营商沟通
7. 履行条款21规定的UDI的义务
8. 履行条款29和31规定的注册义务
9. 欧盟以外的制造商需授权欧代,选择、授权、管理欧代,监督其履行相关义务,变更欧代
10.控制设计变更
11. 建立法规符合性战略,包括符合性评估和变更管理
12. 建立、实施和维护上市后监管体系(条款83)
13. 识别随附文件要求,(指说明书、标签、宣传册、视频文件等)。(来源于产品操作、安全信息披露,附录I第23条、IEC 60601-1 第7章、ISO15223、IEC60601-1-2 制造商宣称、风险管理控制需要的安全信息、剩余风险等)
14. 随附文件需满足成员国官方语言 (翻译控制)
15. 指定合规负责人
16. 经济运营商注册SRN
17. 产品注册
18. 管理UDMADE数据库
19. 管理经销商
20. 管理植入卡 (有源植入)
21. SSCP
22. 保密
23. 处理欧盟境内个人数据,遵守GDPR。有源设备采集患者数据尤其注意
24. 有源设备 特有过程,例如软件开发过程、可用性工程、
25. 对由器械缺陷引起的损害进行赔偿。
法规要求的过程识别后,对各过程在质量手册中进行阐述,明确如下事项:
1. 将识别的过程纳入质量管理体系范围
2. 这些过程对应的程序及质量管理手册对程序的引用
3. 过程之间的关系
4. 执行这些过程的组织内的职责划分(如组织架构含合规负责人、相关人员教育、培训、技能、经验要求、各岗位职责等)
5. 考虑需要配备的资源,如外聘临床专家参与可用性工程、临床评估、风险管理及其他设计开发活动;聘请专业培训机构对人员进行培训;为实现数据保护和保密等建立安全的网络基础设施;购买保险,对由器械缺陷引起的损害进行赔偿等等。
法规要求的过程识别后,新建或者修改现有的程序文件
新建程序及修改
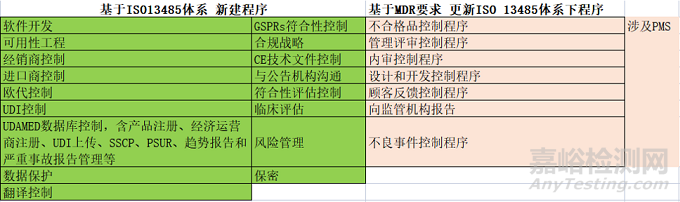
总体要求:明确各过程的责任部门,明确工作流程,参考标准或者条款(如有),明确各过程之间的关系
举例:欧代控制
职责
明确与欧代沟通的责任部门或落实到具体岗位
流程、参考标准或者条款
1.明确欧代筛选、评估、任命、更换的工作流程;明确任命的方式为书面,协议内容应包含条款11中需委托欧代履行的职责。
尤其需要按照条款12的规定明确欧代更换的流程,明确1)撤销欧代及新欧代履行职责的日程;
2.保密及财产处置;
3.以原欧代名义销往市场的产品,其仍有义务将收到的与产品有关的反馈和抱怨告知制造商
各过程关系
明确欧代在上市后监督中应当履行的职责及工作流程;明确欧代在电子数据系统管理中的职责和工作流程;

来源:微珂器械服务


