上市后监督报告PMSR和定期安全更新报告PSUR这两项看似相近的要求,是欧盟医疗器械法规MDR的一大合规难点。作为MDR定义的完全修订的上市后监督活动新要求,PMSR与PSUR被不少人所混淆。针对此情况,本期将探讨解答PSUR和PMSR之间的共同与不同。
PMSR、PSUR在报告内容上的相近
1.上市后监督报告PMSR:需总结在PMS计划中定义的上市后监督(PMS)数据的结果和结论(详见MDR第84条和附录III),以及对上市器械采取的预防和纠正措施的理由和描述。
2.定期安全更新报告PSUR:与PMSR概念近似,PSUR总结在PMS计划中定义的上市后监督PMS数据的结果和结论,并涵盖对上市器械所采取纠正措施的基本原理和描述。
3. PSUR本质上是PMSR的延伸,而PSUR包含高风险器械的附加信息。
PMSR、PSUR在适用对象上的差异
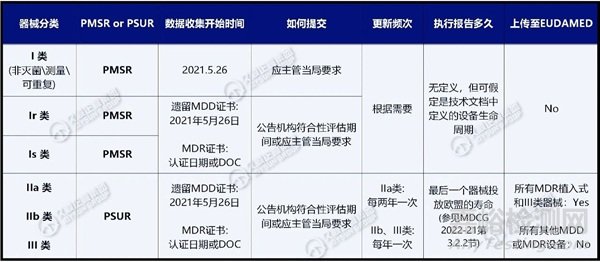
1.上市后监督报告PMSR:适用于低风险的I类器械,PMSR属于技术文档的一部分,并根据需要进行更新,按照要求提供给欧盟主管部门。
2.定期安全更新报告PSUR:适用于IIa类、IIb类和III类器械。
以下用表格总结对比:不同类别器械所需报告类型(PMSR或PSUR)、数据收集起始时间、提交方式、更新频率。注意:PSUR或PMSR的准备要求同样适用于遗留器械型号。
PMSR、PSUR在数据范围上的区别
1.PSUR应概括全部相关PMS数据的总结结果和发现,涵盖PMS所考虑数据:
□严重事故和现场安全纠正措施FSCA的信息;
□非严重事件和不良副作用分析;
□趋势报告;
□来自用户\分销商\进口商的反馈和投诉数据;
□与器械类似的公开可用数据。
2.与PMSR有所区别的是,PSUR还必须包括数据有:
□收益-风险确定的结论;
□上市后临床跟踪(PMCF)的主要发现;
□已上市器械的数量(销售量、出货量、可重复使用器械的使用次数等);
□对器械使用者的体型或其他特征的估计(若已知,则增加使用频率)。