您当前的位置:检测资讯 > 法规标准
嘉峪检测网 2022-03-31 10:39
『背景概述』
2015年2月,FDA发布了最终命令,要求对新的和现有的AED以及必要的AED配件进行上市前批准(PMA)申请。
根据最终命令,所有必要的AED附件的制造商,如电池、pad电极、适配器和儿童用硬件钥匙的制造商,必须在最终命令发布90天内提交PMA申请;
然而,FDA并不打算对这些必要的AED附件在最终命令发布日期后的60个月内强制执行(2020年2月3日)提交PMA的要求。
作为对利益相关方反馈的回应,FDA表示,在2021年2月3日之前,不打算强制执行必要的AED附件的PMA提交要求。
FDA之后发布了一份指南,修订了关于这些必要的AED附件的PMA提交期限的合规政策,宣布FDA在2022年2月3日之前不打算强制执行这些必要的AED附件的PMA提交要求。
这一修订后的合规政策允许医护机构(特别是在COVID-19大流行期间)获得FDA批准的AED,也允许制造商为必要的附件提交所需的PMA。
现在有FDA批准的AED,FDA鼓励医护机构确保其AED是经FDA批准的;如果不是,FDA鼓励开始制定计划,过渡到FDA批准的AED。
『FDA建议』
如果您或您的组织拥有AED系统,FDA建议您:
• 检查下表,看看您的AED是否通过FDA批准。如果您不确定您的AED是否获得FDA批准,请联系您的AED制造商。
• 如果您的AED不是FDA批准的,并且您还没有收到有关您的AED的信件,请联系您的制造商。
• 请注意,如果您的AED未获得FDA批准,在2022年2月3日之后,可能不再提供兼容的必要AED附件来支持您的AED。
• 请联系您的AED或AED附件的制造商,了解您产品的具体信息。
• 鉴于这些设备在紧急情况下的重要性,FDA建议您继续保持您的AED可用,直到您收到FDA批准的AED。
• 通过在MedWatch在线提交自愿报告,向FDA报告AED的问题。
『AED是什么?』
AED是一种便携式救生设备,旨在治疗心脏骤停患者,心脏骤停是一种心脏突然和意外停止跳动的医疗状况。AED系统包括附件,如电池和电极垫,这些都是AED检测和解释心电图和传递电击所必需的。
AED主要有两种类型:公共使用和专业使用。•公共使用的AEDs,即Public access AEDs可以在机场、社区中心、学校、政府大楼、医院和其他公共场所找到。它们的目的是供那些只接受过最少培训的外行使用。
•专业使用的AEDs,即Professional use AEDs用于急救人员,如接受额外AED培训的急救医疗技术人员和辅助医务人员。
AEDs 可以分为半自动或全自动:
•半自动除颤器,即Semi-automated defibrillators,它会分析心律,如果检测到心律异常需要电击,该设备就会提示用户按下按钮进行除颤电击。
•全自动除颤器,即Fully automated defibrillators,它会在没有用户干预的情况下,在设备软件的命令下分析心脏的节律,并进行除颤电击。
『检查你的AED是否是FDA批准的?』
下表中列出了FDA批准的AEDs,只要你的AEDs在这个表中,不管什么时候购买的,都被认为是FDA批准的。FDA会实时更新这个表。
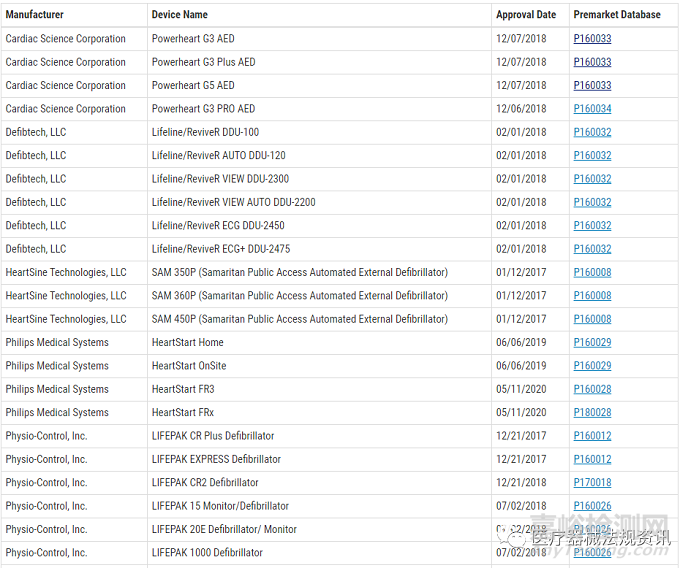

『AED制造商的重要信息』
为了确保AEDs的质量和可靠性,FDA现在要求制造商获得所有AEDs的PMA。
目前合法销售的必要AED附件,如电池、pad电极、适配器和儿科使用的硬件钥匙,制造商必须在2022年2月3日之前提交PMA。
如果在2022年2月3日前没有提交PMA,制造商必须停止销售其附件。
FDA希望必要的AED附件将与FDA批准的AED设备(在上面的列表中)一起使用。为必要的AED附件提交PMA的制造商应意识到,在PMA未决期间,他们可以继续销售这些附件,直到FDA发布决定(批准、不批准或拒绝决定)。在PMA做出决定后,只有FDA批准的附件可以继续销售。

来源:医械法规资讯


