您当前的位置:检测资讯 > 法规标准
嘉峪检测网 2021-10-21 21:45
9月17日,国家药监局、国家卫生健康委、国家医保局联合发布《关于做好第二批实施医疗器械唯一标识工作的公告》(以下简称《公告》)。《公告》明确,在第一批实施医疗器械唯一标识的九大类69个品种基础上,将其余第三类医疗器械(含体外诊断试剂)纳入第二批实施唯一标识范围。2022年6月1日起,生产的第二批实施品种应当具有医疗器械唯一标识。
01、什么是医疗器械唯一标识(UDI)
简单来说,医疗器械唯一标识即UDI(Unique Device Identification)由两部分构成即UDI=DI+PI。DI即Device Identifier,产品标识(或器械识别码),是UDI的固定和强制性部分,是识别医疗器械注册人或者备案人、医疗器械型号规格和包装的唯一码;PI即Production Identifier,生产标识(或生产识别码)是UDI的可变和非强制性部分,根据监管和实际应用需求可包含医疗器械序列号、生产批号、生产日期、失效日期等。生产标识是识别医疗器械生产过程相关数据的代码。
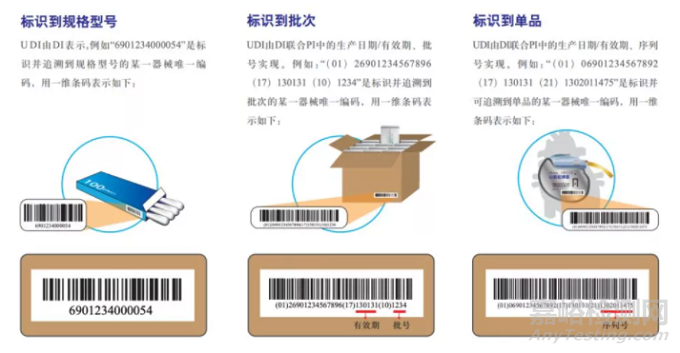
一张图看懂UDI到底包含哪些信息
02、医疗器械纳入UDI有哪些好处?
1、减少信息输入误差,提高物流管理效率,方便产品溯源
全球采用统一的、标准的UDI有利于提高供应链透明度和运作效率;有利于降低运营成本;有利于实现信息共享与交换;有利于不良事件的监控和问题产品召回,提高医疗服务质量,保障患者安全。一个UDI码,可能扫出无数有效信息,可以说UDI就像是医疗器械的“电子身份证”。这一认证贯穿医疗器械生产、流通和使用的各个环节,可以助推医疗器械全生命周期管理,同时能有效提升医疗器械精准化管理水平。
2、有利于三医联动的开展
国家一直致力于推动三医联动,而UDI的应用则是实现三医联动的一大重要举措。三医联动就是医保体制改革、卫生体制改革与药品流通体制改革联动,通俗地说即是:医疗、医保、医药改革联动,即“三医联动”。采用统一的、标准的UDI有利于提高供应链透明度和运作效率;有利于降低运营成本;有利于实现信息共享与交换;有利于不良事件的监控和问题产品召回,提高医疗服务质量,保障患者安全。通过UDI的信息公开和数据共享,政府管理部门可实现透明溯源、智慧监管;医疗机构可以减少用械差错、提升相关管理水平;消费者能够放心使用、明白消费;从产业角度看,则可以建立产品追溯体系,加强行业自律,提升企业管理效能,助推医疗器械产业高质量发展。有助于提升卫生、医保、海关等部门对于医疗器械临床使用、招标采购、医保结算、进口通关等环节的管理效率。

来源:Medtec医疗器械设计与制造


