您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2021-08-16 09:59
更多医药技术资讯,请点击医药专栏:http://drug.anytesting.com/ 欢迎关注文末微信公众号:药研检测drugtest
今日头条
国产首个LILRB2抗体获批临床。以明生物新型LILRB2抗体IO-108获FDA批准,即将开展用于治疗实体瘤的I期临床。在临床前研究中,IO-108单药可以逆转髓系细胞由于被“肿瘤调节”而导致的抗炎表型,并促进单核细胞分化成促炎性的树突状细胞;还可以增强PD-1阻断性抗体对CD4+T细胞在与异体巨噬细胞共培养时的激活作用。该项研究将由一个单药治疗队列和一个联合治疗队列组成,评估IO-108单药以及与PD-1抗体联用的安全性和耐受性等。
国内药讯
1.四环医药CDK4/6抑制剂上III期临床。四环生物子公司轩竹生物开发的1类创新药吡罗西尼(Birociclib,XZP-3287)获国家药监局批准,即将开展吡罗西尼联合氟维司群用于既往曾接受内分泌治疗后疾病进展的HR+/HER2-局部晚期、复发或转移性乳腺癌的III期临床。目前国内已有3个企业(礼来、辉瑞和齐鲁制药)的CDK4/6抑制剂获批上市;还有8个企业同靶点药物处于申请上市阶段,包括恒瑞、豪森、先声药业等。
2.复宏汉霖LAG-3单抗启动临床。复宏汉霖LAG-3单抗登记启动一项针对晚期实体瘤或淋巴瘤的I期临床。目前的LAG-3单抗在研项目主要将LAG-3单抗和PD-1进行联用,探索这一免疫疗法组合在不同癌种中的疗效。全球范围内进展最快的是百时美施贵宝,该公司开发的Relatlimab是唯一已经进入III期临床的LAG-3单抗项目。根据Insight数据库,在国内,10个LAG-3单抗项目和4个LAG-3双抗项目正在进行中。
3.百利药业四特异性抗体启动临床。百利药业登记启动一项CD3/4-1BB/PD-L1/ROR1四特异性抗体GNC-035的I期临床,拟评估GNC-035在复发或难治性血液系统恶性肿瘤和局部晚期或转移性实体瘤中的安全性、耐受性、药代动力学/药效动力学及抗肿瘤活性。今年以来,百利药业已启动了3项多特异性抗体的临床研究,包括两款GNC-035、GNC-039的首次临床试验,以及EGFR/HER3双抗SI-B001 针对复发转移性头颈部鳞状细胞癌的II期临床研究。
4.信达生物CD73单抗获批临床。信达生物1类新药IBI325获国家药监局临床试验默示许可,拟用于晚期恶性肿瘤的治疗。IBI325是一款CD73单抗。目前,全球范围内尚未有该靶点药物获批上市;国内同靶点药物以天境生物的uliledlimab进展最快,已处于II期临床阶段,海正博锐处于I期临床,康方、信达获批临床。今年6月,复宏汉霖自主开发的CD73单抗HLX23也获得FDA临床许可。
5.天演药业CTLA-4前抗体国内报IND。天演药业1类治疗用生物制品ADG126的临床试验申请获CDE受理。ADG126是一款新型CTLA-4全人源IgG1前抗体,由Adagene公司领先SAFEbody™ 技术平台开发,抗体在肿瘤微环境中被特定酶有条件激活后,才能与CTLA-4特异性结合。今年3月,天演药业已开展ADG126用于治疗晚期实体瘤的国际I期临床。此外,该公司还将开展两项联合用药研究,评估ADG126和另一款抗CTLA-4单抗ADG116联合Keytruda用于晚期/转移性实体瘤患者的疗效。
国际药讯
1.两款mRNA新冠疫苗第三剂获批EUA。FDA宣布扩展辉瑞/BioNTech联合开发的mRNA新冠疫苗BNT162b2和Moderna开发的新冠疫苗mRNA-1273的紧急使用授权(EUA),允许接受实体器官移植或因为疾病出现免疫功能低下的患者接种第三剂增强疫苗。根据公开信息,针对Delta变种,接种第三剂BNT162b2后,中和抗体滴度在18-55岁成人中提高5倍以上,在65-80岁老年人中提高11倍以上;而且第三次接种具有与先前一致的耐受性特征与良好的安全性。
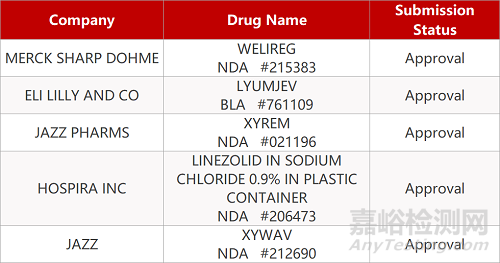
2.默沙东首创抗癌疗法获批上市。FDA批准默沙东新型口服HIF-2α抑制剂Welireg(belzutifan)上市,用于治疗von Hippel-Lindau(VHL)疾病相关癌症,如肾细胞癌(RCC)、中枢神经系统(CNS)血管母细胞瘤或胰腺神经内分泌肿瘤(pNET)。在一项Ⅱ期临床中,在VHL相关RCC患者中报告的客观缓解率(ORR)为49%(95% CI:36,62);在其他VHL相关非RCC肿瘤患者中,24例可评估的CNS血管母细胞瘤患者的ORR为63%,12例可评估的pNET患者的ORR为83%。
3.羟丁酸盐获FDA批准治疗嗜睡。Jazz公司羟丁酸盐产品Xywav获FDA批准新适应症,用于治疗成人特发性睡眠过度症。Xywav也是首个适用于治疗特发性睡眠过度症的药物。在一项Ⅲ期临床中,与安慰剂相比,接受Xywav治疗的患者在Epworth嗜睡量表评分的主要终点、和评估嗜睡严重程度的次要终点上均具有统计学意义的显著改善。
4.强生治疗MS口服新药在英上市。英国药品及保健品管理局(MHRA)批准强生新型口服选择性S1P1调节剂Ponvory(ponesimod)用于治疗临床或影像学鉴定患有活动性疾病的复发型多发性硬化(RMS)患者。在一项Ⅲ期临床OPTIMUM中,与Aubagio相比,Ponvory将患者的年化复发率(ARR)显著降低30.5%(ARR:0.202vs0.290;p=0.0003);将大脑中新的或扩大的炎性病灶显著减少56%(p<0.0001)。
5.外用HDAC抑制剂Ⅱ期临床积极。Medivir公司外用HDAC抑制剂remetinostat辅助治疗基底细胞癌(BCC)患者的Ⅱ期临床结果积极。最终分析显示,remetinostat在33个肿瘤中的总缓解率(ORR)达到69.7% [90% CI, 54%–82.5%];肿瘤直径平均缩小约62%,肿瘤面积缩小约71%;在病理检查中,54.8%肿瘤完全消退;安全性方面,未报告全身性不良事件。详细数据已发表在Clinical Cancer Research上。
6.创新NASH疗法早期临床积极。CohBar公司线粒体衍生肽(MDP)药物CB4211在非酒精性脂肪性肝炎(NASH)和肥胖症患者中进行的Ⅰa/Ⅰb期临床达主要终点。CB4211显示出良好的耐受性与安全性,未报告严重的不良事件。此外,对探索性药效学终点的评估表明,在治疗4周后,与安慰剂相比,患者关键的肝损伤生物标志物ALT(-21%vs4%)和AST(-28%vs-11%)显著降低,葡萄糖水平显著下降,体重有下降的趋势。
医药热点
1.日本日增新冠确诊病例首超2万例。日本13日通报日增新冠确诊病例数首次超过2万例,连续三天刷新纪录。全国47个都道府县中,16个都府县当天新增确诊病例数创新高。有专家建议,政府应将实施紧急状态的范围扩大至全国。东京都13日报告新增确诊病例5773例,刷新5日5042例的纪录;重症患者增至227人,同样创新高。东京都7月12日起第四次进入紧急状态,至今已满一个月。
2.医师资格考试延期。国家卫健委医师资格考试委员会日前发布通知,为统筹做好新冠肺炎疫情防控和医师资格考试工作,保障人民群众健康权益,确保考生、考务人员安全和考试安全,原定于2021年8月20日至22日在全国举行的医师资格考试医学综合考试延期举行,具体时间另行通知。请各位考生按照疫情防控要求做好个人防护,认真备考,及时关注考试有关通知。
3.我国拟立法明确医师公共场所自愿施救不担责。十三届全国人大常委会第三十次会议将于8月17日至20日在北京举行。13日,全国人大常委会法工委举行记者会,通报本次常委会会议拟审议的法律草案的主要情况。关于医师法草案,草案三审稿将进一步充实对医师的保障措施,明确医师在公共场所因自愿实施急救造成受助人损害的,不承担民事责任。明确医疗机构应当参加医疗责任保险或者建立、参加医疗风险基金。
4.国家卫健委拟连续4年整治红包、回扣。8月12日,国家卫健委医政医管局发布《关于印发全国医疗机构及其工作人员廉洁从业行动计划(2021-2024年)的通知》明确,将持续纠治医疗领域的不正之风,维护医疗行业公平正义,自2021年至2024年,集中开展整治“红包”、回扣专项行动。这是在一年一度的纠风工作基础上,医药行业首次迎来以4年为周期的廉洁从业行动计划。
审评动向
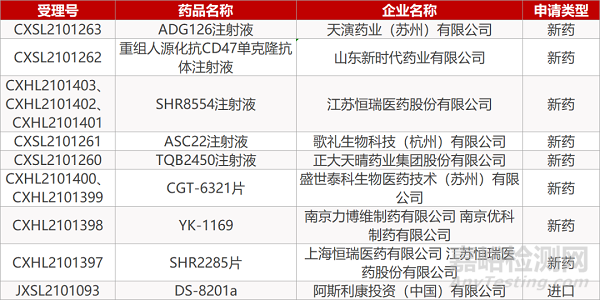
申请临床:
天演药业的ADG126注射液、山东新时代的重组人源化抗CD47单克隆抗体注射液、江苏恒瑞的SHR8554注射液(3个规格)、歌礼生物的ASC22注射液、正大天晴的TQB2450注射液、盛世泰科的CGT-6321片(2个规格)、南京力博维制药/南京优科的YK-1169、上海恒瑞/江苏恒瑞的SHR2285片、阿斯利康的DS-8201a。
申请生产:

来源:药研发


