您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2021-03-03 09:23
更多医药技术资讯,请点击医药专栏:http://drug.anytesting.com/ 欢迎关注文末微信公众号:药研检测drugtest
今日头条
大品种脂肪乳注射制剂首家通过一致性。科伦药业脂肪乳注射液(C14~24)获国家药监局批准通过一致性评价,为国内首家。脂肪乳注射液(C14~24)主要用于胃肠外营养补充能量及必需脂肪酸,是全球首个上市的肠外营养脂肪乳剂。2019年中国公立医疗机构终端脂肪乳注射液(C14~24)销售额超过7亿元。其中,力邦制药占据30.64%的市场份额,费森尤斯卡比占比30.03%,科伦药业占比23.83%。
国内药讯
1.三生国健RVO相关项目启动II期临床。三生国健重组抗VEGF单抗601A视网膜静脉阻塞(RVO)项目II期临床首例受试者入组。该项研究旨在评估601A(眼科)在视网膜分支静脉阻塞(BRVO)/中央静脉阻塞(CRVO)所致黄斑水肿病变患者中的安全性和有效性。在已完成的两项I期临床中,包括年龄相关性黄斑变(AMD)和糖尿病黄斑水肿(DME)病人单剂量和多剂量爬坡试验,601A显示出良好的安全性和耐受性。
2.默沙东CTLA-4单抗联合疗法在华获批临床。默沙东1类新药MK-1308A注射液获CDE一项临床试验默示许可,适应症为晚期实体瘤。MK-1308A是MK-1308和默沙东PD-1抑制剂Keytruda(pembrolizumab)的联合治疗方案,其中MK-1308是默沙东从康方生物引进的一款抗CTLA-4抗体。一项公布在IASLC2020会议上的Ⅰ/Ⅱ研究显示,这一联合疗法在NSCLC患者中的整体客观缓解率(ORR)达到35.1%,中位无进展生存期(PFS)为6.1个月,中位总生存期(OS)为16.5个月。
3.瓴路药业合作品种CD19靶向ADC获批临床。瓴路药业与ADC Therapeutics联合申报的注射用loncastuximab tesirine(Lonca,ADCT-402)获CDE一项临床试验默示许可,针对的适应症为特定弥漫性大B细胞淋巴瘤或套细胞淋巴瘤患者。Lonca是ADC Therapeutics开发的一款靶向CD19的抗体偶联药物(ADC),其在美国的上市申请已被FDA授予优先审评资格。如果获批,它将有望成为首款CD19靶向ADC疗法。
4.友芝友生物PD-L1/TGF-β双抗申报临床。友芝友生物1类新药重组PD-L1/TGF-β双特异性抗体注射液(Y101D)的临床试验申请获CDE受理。Y101D是友芝友生物自主开发的第四个双抗新药,已在多种小鼠肿瘤模型中显示出显著的肿瘤抑制效果。FDA已于2021年1月批准Y101D在美国进行临床试验,开展针对局部晚期或转移性肿瘤的临床研究。
5.诺诚健华任命张向阳担任首席医学官。诺诚健华3月1号宣布,任命张向阳博士担任首席医学官(CMO),向诺诚健华联合创始人、董事长兼CEO崔霁松博士汇报,全面负责公司全球临床开发战略和执行。据公开信息,张向阳是一名拥有医生从业经验的科学家,早期在北京301医院担任胃肠病专科医师和临床研究人员。曾在GSK、BMS和强生等跨国企业工作。在加入诺诚健华之前,担任Hengrui Therapeutics公司CEO。
国际药讯
1.近10年罕见病药物临床开发成功率达17%。2月28日是第14个“国际罕见病日”。根据最新发布的一份药物临床开发成功率报告:在2011年-2020年,罕见病(不含肿瘤适应症)药物从Ⅰ期临床到获得FDA批准上市的平均成功率为17.0%,高于整体药物的平均开发成功率7.9%;而在2020年FDA批准的新药中,孤儿药占比也达到近10年来的新高。根据报告,罕见病药物临床从Ⅰ期进入Ⅱ期、Ⅱ期进入Ⅲ期、Ⅲ期到提交上市申请以及提交申请到获得FDA批准的成功率分别为67.4%(n=380)、44.6%(n=464)、60.4%(n=240)和93.6%(n=172)。
2.新一代角膜交联疗法达Ⅲ期试验主要终点。Glaukos Corporation公司新一代角膜交联iLink疗法Epi-on治疗圆锥角膜的关键Ⅲ期试验达主要疗效终点。与安慰剂组相比,Epi-on治疗组患者从基线到6个月时的最大角膜曲率(Kmax)获得统计学意义的显著改善,Kmax治疗效应为-1.0D(p=0.0004);第12个月时Kmax治疗效果为-1.1D(p=0.0001);该治疗通常耐受良好,没有患者因不良事件而提前停药。Glaukos公司计划2022年向FDA提交Epi-on的NDA申请。
3.NEJM发表脊髓性肌萎缩症口服疗法Evrysdi关键数据。PTC Therapeutics与基因泰克开发的SMN2基因剪接调节剂Evrysdi(risdiplam)在治疗症状性1型脊髓性肌萎缩症(SMA)婴儿患者的关键研究FIREFISH的剂量探索研究中获积极结果。SMA婴儿患者在12个月时表现出生存和发育的显著改善:有90%(19/21)的婴儿患者在没有永久通气的情况下活着;有41%(7/17)患者在没有支持的情况下坐起来至少5秒;有52%(11/21)的患者的CHOP-INTEND总分≥40分。详细结果发表在NEJM期刊上。
4.新型基因疗法OCU400获欧盟孤儿药资格。欧盟委员会(EC)授予Ocugen公司新型基因疗法OCU400(AAV5-hNR2E3)孤儿药资格,用于治疗视网膜色素变性(RP)和Leber先天性黑矇(LCA)。该疗法采用AAV载体,将核激素受体基因NR2E3的功能性拷贝递送至视网膜中的靶细胞,可能有助于重置视网膜稳态,具有稳定细胞和挽救光感受器变性的潜力。发表在Nature Gene Therapy上的临床前结果证明了修饰基因疗法在早期和晚期视网膜色素变性中的广谱治疗益处。
5.默沙东撤回Keytruda小细胞肺癌上市资格。默沙东宣布,在与FDA沟通后,决定撤回PD-1疗法Keytruda(pembrolizumab)用于治疗经治的转移性小细胞肺癌(SCLC)的适应症批准。2019年6月,FDA基于KEYNOTE-158(G组)和KEYNOTE-028(C1组)的肿瘤应答率和应答数据的持久性,加速批准Keytruda用于治疗SCLC的上市申请。但在上市后的确证性Ⅲ期试验KEYNOTE-604中,Keytruda达到了无进展生存的主要终点,但另一个主要终点OS指标没有达到统计学意义的改善。
6.默克收购头颈癌靶向药。Debiopharm公司宣布与德国默克就其”first-in-class“IAP拮抗剂xevinapant(Debio1143)在全球开发和商业化签署了独家许可协议。Xevinapant目前正处于Ⅲ期开发阶段,FDA已授予其突破性疗法认定,联合标准治疗、含铂化疗和标准分割调强放疗,用于一线治疗局部晚期头颈部鳞状细胞癌(LA SCCHN)患者。根据协议,两家公司共同资助Ⅲ期注册TrilynX研究;Debiopharm将获得1.88亿欧元的预付款和最高达7.1亿欧元的里程碑付款和特许权使用费。
医药热点
1.三款国产PD-1医保价格公布。2020版国家医保目录3月1日正式启用,药品总数为2800种,其中,西药1426种,中成药1374种。新版医保目录共纳入119种新药,降幅50.64%。新增17种抗癌药,其中,PD-1医保支付价格:恒瑞医药卡瑞利珠单抗,2928元/200mg/支,降幅85%,肝癌、食管癌、肺癌、淋巴瘤4大适应症均纳入医保;百济神州替雷利珠单抗,2180元/100mg/支,降幅80%;君实生物特瑞普利单抗,906.08元/80mg/支,1074.87元/100mg规格/支,2100.97元/240mg/支,降幅也超过70%。在医保助力下,PD-1每年治疗费跌破万元。
2.北京规范互联网医院许可管理。北京市卫健委、中医管理局联合发出通知,明确北京市互联网医院许可管理的准入、命名规则以及变更登记、监督管理等要求。通知要求,互联网医院执业前,必须向核发《设置医疗机构批准书》的卫健行政部门申请登记,领取《医疗机构执业许可证》。审核不合格的,不予核发《医疗机构执业许可证》。合作建立的互联网医院,合作方发生变更或出现其他合作协议失效的情况时,需要重新申请设置互联网医院。
3.中国专家发现新冠肺炎重症患者康复的关键因素。刊登在国际学术期刊《免疫学前沿》上的一篇来自上海市公共卫生临床中心卢洪洲教授和周晓辉教授科研团队的最新研究论文显示,与健康人对照组相比,新冠重症和危重患者、普通型患者中的T细胞,特别是CD4+T细胞的比例降低。该研究为深入理解新冠病毒感染致病的免疫机制和指导新冠重症患者的临床救治有重要参考意义。
审评动向
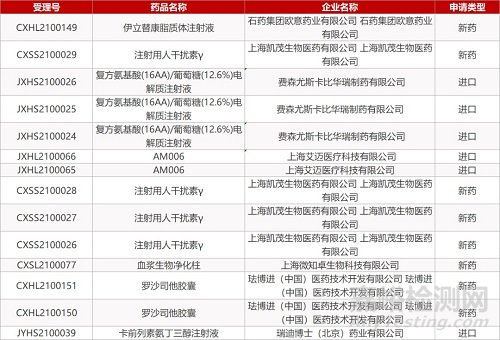
1. CDE新药受理情况(03月02日)
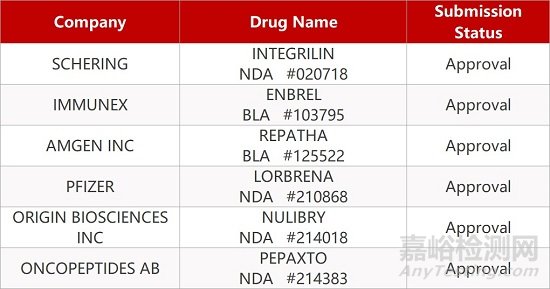
2. FDA新药获批情况(北美02月28日)
股市资讯
【维康药业】公司近日收到国家药监局核准签发的药品补充申请批准通知书,同意天寿药业、绿叶制药将金钱草胶囊药品生产技术转让给公司,同意绿叶制药将肝苏胶囊的药品生产技术转让给公司。金钱草胶囊功能主治清利湿热,通淋,消肿,肝苏胶囊功能主治降酶,保肝,退黄,健脾。
【天药股份】近日公司产品倍他米松磷酸钠原料药通过国家药品监督管理局药品审评中心技术审评,在原料药、药用辅料和药包材登记信息公示平台上显示登记状态标识转为A。倍他米松磷酸钠是肾上腺皮质激素类药物,主要用于过敏性与自身免疫性炎症性疾病;活动性风湿病、类风湿性关节炎、红斑狼疮、严重支气管哮喘、严重皮炎、急性白血病等;某些感染的综合治疗。
【一品红】近日公司全资子公司广州一品红制药有限公司收到国家药品监督管理局核准签发的《药品补充申请批准通知书》,公司生产的注射用阿昔洛韦成为该类品种首家通过一致性评价的品种。注射用阿昔洛韦适用于单纯疱疹病毒感染及免疫缺陷者水痘的治疗。

来源:药研发


