您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2021-02-04 09:58
更多医药技术资讯,请点击医药专栏:http://drug.anytesting.com/ 欢迎关注文末微信公众号:药研检测drugtest
「 本文共:16条资讯,阅读时长约:3分钟 」
今日头条
拜耳前列腺癌新药中国获批上市。拜耳和Orion公司联合开发的新型口服雄激素受体(AR)抑制剂darolutamide(ODM-201)薄膜衣片获国家药监局批准上市,用于非转移性去势抵抗性前列腺癌(nmCRPC)患者的治疗。一项针对nmCRPC患者的Ⅲ期研究显示,ODM-201治疗组患者的中位无转移生存期为40.4个月,而对照组为18.4个月,ODM-201组将患者出现癌症转移或死亡的风险降低了59%。
国内药讯
1.我武生物「黄花蒿花粉变应原舌下滴剂」获批上市。我武生物「黄花蒿花粉变应原舌下滴剂」获国家药监局批准,该品种是一种变应原提取物,作为特异性免疫治疗用于经过敏原检测为黄花蒿/艾蒿花粉过敏引起的变应性鼻炎(或伴有结膜炎)的成年患者。黄花蒿花粉变应原舌下滴剂与该公司现有主导产品粉尘螨滴剂互为补充,有望为更多过敏性疾病患者提供不同的变应原脱敏治疗药物。
2.信达生物达伯舒一线治疗非鳞状NSCLC获批。信达生物/礼来PD-1信迪利单抗注射液(达伯舒®)获国家药监局批准,联合培美曲塞和铂类化疗用于非鳞状非小细胞肺癌(NSCLC)的一线治疗。这也是达伯舒®继2018年12月首次获批用于治疗至少经过二线系统化疗的复发或难治性经典型霍奇金淋巴瘤后,所获批的第二项适应症。在一项III期研究(ORIENT-11)中,这一组合显著延长了无进展生存期(PFS),治疗组和对照组中位PFS分别为8.9个月和5.0个月,HR(95%CI)=0.482(0.362,0.643),P<0.00001。
3.阿斯利康「达格列净」心衰适应症在华获批。阿斯利康达格列净片新适应症已获NMPA批准,用于治疗射血分数降低的心力衰竭(HFrEF)成人患者,以降低心血管死亡和心力衰竭恶化的风险,并改善心力衰竭症状。达格列净是一种SGLT2抑制剂,已在中国获批用于治疗2型糖尿病,商品名为安达唐。去年12月,达格列净通过续签方式以2.56元(5mg/片),4.36元(10mg/片)价格纳入2020年医保目录。
4.百济神州白蛋白紫杉醇新适应症即将获批。百济神州/新基注射用紫杉醇(白蛋白结合型)新适应症上市申请处于“在审批”阶段,有望近期获批,联合吉西他滨用于一线治疗转移性胰腺癌(mPC)。白蛋白紫杉醇(商品名Abraxane)由Abraxis BioScience公司开发,是一种紫杉醇与白蛋白结合的全新制剂,此前已获NMPA批准用于治疗转移性或复发性乳腺癌。目前,Abraxane持证商为百时美施贵宝,百济神州拥有该品种在中国市场的权益。
5.安进PDE4抑制剂阿普斯特中国申报上市。安进阿普斯特片(apremilast)新药上市申请获CDE受理。阿普斯特原来是百时美施贵宝(BMS)旗下新基公司开发的一款新型口服小分子PDE4抑制剂,目前在美国已获批用于治疗活动性银屑病关节炎、白塞病相关口腔溃疡以及适合光疗或全身治疗的中重度斑块型银屑病患者。安进拥有该新药的全球权益。在中国,阿普斯特已被纳入第一批临床急需境外新药。
国际药讯
1.俄罗斯新冠疫苗老年人群保护力达91.8%。俄罗斯基于两种不同腺病毒载体的新冠疫苗Sputnik V在Ⅲ期临床中获积极中期结果。78例COVID-19患者的数据表明,Sputnik V预防COVID-19的效力达到91.6%;进一步分析同时显示,这款疫苗在60岁以上老年人中的防护能力也达到91.8%;没有发现与疫苗相关的死亡和严重不良反应,最常见的不良反应为注射部位疼痛和流感样症状。详细结果发表在《柳叶刀》上。
2.强效FGFR激酶抑制剂Pemazyre欧盟即将获批。欧洲药品管理局人用医药产品委员会(CHMP)推荐有条件批准Incyte公司FGFR激酶抑制剂Pemazyre(pemigatinib)上市,用于治疗经治的、FGFR2融合或重排、不能手术切除的局部晚期或转移性胆管癌患者。如果获批,Pemazyre将成为欧洲针对这类患者的首个靶向疗法。在一项FIGHT-202研究中,在携带FGFR2融合或重排的患者(队列A)中,中位随访到15个月时,Pemazyre的总缓解率为36%,中位缓解持续时间为9.1个月。
3.FDA批准帕金森病新药Gocovri扩展适应症。Adamas Pharmaceuticals公司缓释胶囊 Gocovri(amantadine,金刚烷胺)的补充新药申请获FDA批准,作为左旋多巴/卡比多巴的辅助疗法,用于治疗帕金森病患者的“关闭期”发作(OFF episodes)。Gocovri是一种非竞争性NMDA受体拮抗剂,已于2017年获FDA批准用于治疗接受左旋多巴治疗的帕金森病患者的运动障碍。它是目前唯一一款获批同时治疗运动障碍和“关闭期”发作的帕金森病疗法。
4.TYK2别构抑制剂治疗银屑病达到Ⅲ期终点。百时美施贵宝口服TYK2抑制剂deucravacitinib治疗中重度斑块状银屑病的第二个关键性Ⅲ期临床POETYK PSO-2中达主要终点。与安慰剂相比,deucravacitinib显著提高达到PASI 75(银屑病面积和严重程度指数改善至少75%)和皮肤症状清除或几乎清除(sPGA为0或1)的患者比例;deucravacitinib在主要终点的表现也优于常见口服PDE4抑制剂。详细结果将于医学会议上分享。
5.“best-in-class” PDE4抑制剂达到Ⅲ期临床终点。Arcutis Biotherapeutics选择性PDE4抑制剂roflumilast(ARQ-151)乳剂治疗斑块状银屑病的两项关键性Ⅲ期临床结果积极。两项试验总计881例患者接受0.3% roflumilast乳剂或赋形剂乳剂的治疗,DERMIS-1试验中(8周后)研究者总体评估(IGA)成功率达到42.2%,对照组这一数值为6.1%(p<0.0001);DERMIS-2试验中IGA成功率为37.5%,对照组为6.9%(p<0.0001);此外,roflumilast还达到一系列次要终点。该公司计划今年下半年向FDA递交新药申请。
6.Horizon拟收购免疫性疾病药物研发公司Viela Bio。Horizon Therapeutics将以约30.5亿美元收购Viela Bio,并囊获Viela Bio已获批用于治疗视神经脊髓炎谱系疾病(NMOSD)的CD19单抗Uplizna(inebilizumab-cdon),以及研发管线中的CD40L融合蛋白VIB4920和pDC靶向单抗VIB7734等多款在研疗法。VIB4920可以阻断CD40/CD40L共刺激通路,目前正在Ⅱ期临床中用于治疗干燥综合征,肾移植排斥反应和类风湿性关节炎。VIB7734旨在清除pDC(对多种自身免疫性疾病的发病机制至关重要的细胞类型),其治疗系统性红斑狼疮(SLE)的Ⅱ期临床预计今年上半年开始。
医药热点
1.中国免疫细胞治疗协作组成立。中国免疫细胞治疗协作组于首届中国血液学发展大会上正式成立。协作组将围绕血液系统重大疾病、难治性疾病和CAR-T等细胞治疗关键问题,联合领域的机构,开展技术分工合作,形成技术标准,建立公共技术平台, 推动CAR-T等细胞治疗临床硏究规范化进程、建立全国临床硏究数据库和生物样本库,促进细胞治疗研究与临床转化的健康发展。
2.官方公布改善医疗服务先进典型名单。国家卫健委发布《关于通报表扬2018~2020年改善医疗服务先进典型的通知》。《通知》明确,从改善医疗服务的5项工作制度和10项创新举措等15个方面,对北京大学第三医院等484家医院、北京同仁医院门诊部等476个科室、北京同仁医院田玮等443名个人予以通报表扬。对积极组织辖区内医疗机构参与宣传报道活动的天津市卫生健康委等9个单位,以及积极面向社会开展宣传引导的北京医院等15家医院予以通报表扬。
3.无国家医保药品编码药品将不能在江苏申报阳光采购。2月1日,江苏省发文要求做好省平台国家医保药品分类与代码标准化工作。省平台已经挂网的产品对应的企业应通过省交易平台确认或关联,并对已关联产品的“国家医保药品分类与代码”字段进行确认和更正。截止3月31日,未维护或维护错误的已挂网产品将被撤网。此外,无国家医保药品分类与代码的未挂网产品2月16日起将不能申报江苏省药品阳光采购。
4.英国蔓延的新冠病毒变种再次发生突变。据英媒2日报道,英国卫生专家在英国此前报告的新冠病毒变异株样本中观察到了一种新突变,该突变此前已在南非报告的新冠病毒变异株中被观察到,这一新突变可能会帮助新冠病毒躲避人体免疫系统的攻击。目前,英国已出现105例南非报告的新冠病毒变异株感染病例,为遏制这一变异株的传播,英国2日开始对8个地区的大约8万人“挨家逐户”检测新冠病毒。
股市资讯
【海思科】全资子公司辽宁海思科制药有限公司产品创新药环泊酚注射液获药品注册证书,适用于全身麻醉诱导。
【信达生物】PD-1抑制剂达伯舒(信迪利单抗注射液)获药监局就其新适应症申请(sNDA)的批准,联合培美曲塞和铂类化疗用于非鳞状非小细胞肺癌(NSCLC)的一线治疗。
【恒瑞医药】产品SHR2150胶囊获药物临床试验批准,拟用于HIV-1感染患者的治疗的临床试验。
审评动向
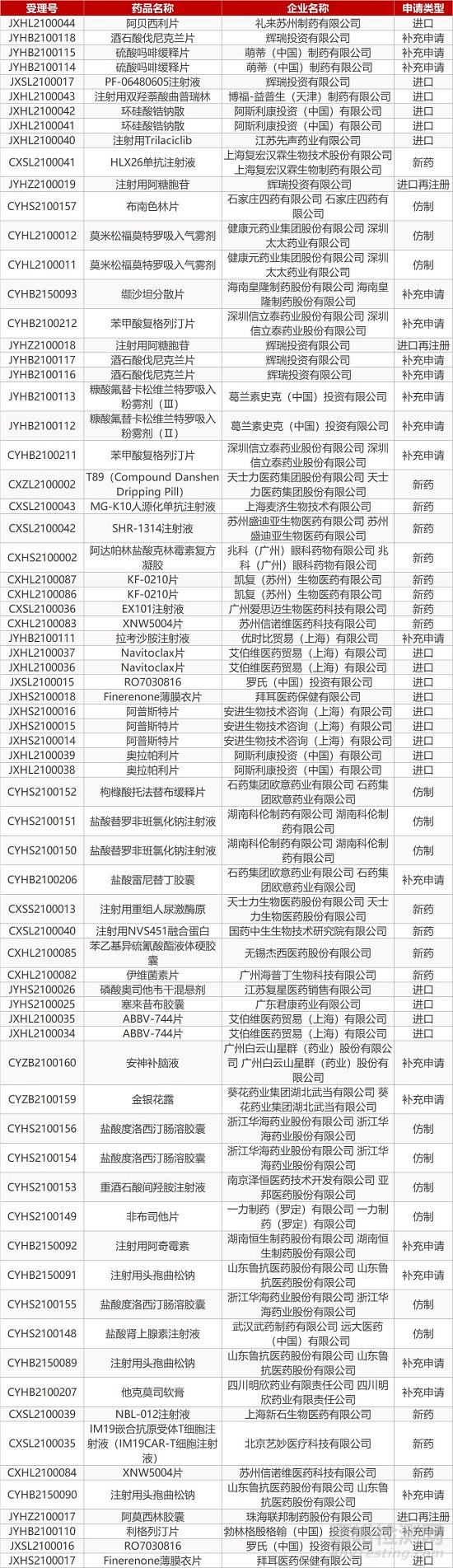
1. CDE最新受理情况(02月03日)
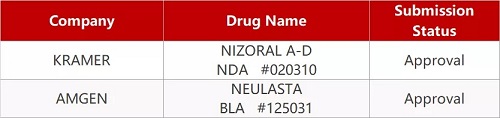
2. FDA最新获批情况(北美02月02日)

来源:药研发


