您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2020-12-14 09:35
更多医药技术资讯,请点击医药专栏:http://drug.anytesting.com/ 欢迎关注文末微信公众号:药研检测drugtest
「 本文共:15条资讯,阅读时长约:3分钟 」
今日头条
国内药讯
1.信达CTLA-4单抗联合PD-1启动关键II期临床。信达生物CTLA-4单抗IBI310联合PD-1信迪利单抗(达伯舒®)在治疗二线及以上晚期宫颈癌的II期关键临床NCT04590599中完成首例患者入组及给药。该项研究拟在174例经一线及以上含铂化疗失败的晚期宫颈癌患者中评估IBI310或安慰剂联合达伯舒®治疗的有效性和安全性。目前全球仅有一个CTLA-4靶向的抗体药物获批上市,国内尚无获批上市的CTLA-4靶向药物。
2.万春医药普那布林公布关键Ⅲ期最新结果。万春医药“first-in-class”GEF-H1激活剂普那布林联合培非格司亭,在针对接受化疗(多西他赛、阿霉素和环磷酰胺)乳腺癌患者的国际Ⅲ期研究PROTECTIVE-2中获积极最新数据。该研究不仅(在11月中旬)达到了主要终点和关键次要终点,最新数据还显示,与培非格司亭单药相比,联合治疗使严重中性粒细胞减少症PN的发生率降低了53%(21.6%vs46.4%),使发热性中性粒细胞减少症FN发作风险降低了41%。详细数据已在SABCS2020年会上展示。
3.全球首款皮下注射PD-L1美国注册临床进展。康宁杰瑞与思路迪医药、TRACON公司联合宣布:恩沃利单抗注射液(KN035)在美国的一项注册临床(ENVASARC)完成首例患者给药。该研究旨在评估KN035用于治疗既往非免疫检查点抑制剂治疗失败的多形性肉瘤(UPS)/纤维组织细胞肉瘤(MFS)患者,计划入组160例患者。KN035是康宁杰瑞自主研发、思路迪医药负责其肿瘤适应症临床开发的PD-L1抗体,是全球首个进入注册临床试验的皮下注射PD-1/L1抗体。
4.辉瑞JAK3抑制剂拟纳入突破性疗法认证。辉瑞(Pfizer)口服JAK3抑制剂PF-06651600片(ritlecitinib )获CDE纳入拟突破性疗法认定公示名单,用于≥12岁斑秃患者(包括全秃[AT]和普秃[AU])的治疗。在一项II期临床中,与安慰剂相比,PF-06651600显著降低了中重度斑秃患者的SALT评分(脱发严重程度评分),两组患者SALT评分较基线分别下降了32.5分和1.41分。该疗法已于2018年9月获FDA突破性疗法认定,目前正在III期临床Phase 中用于治疗斑秃。
5.合源生物CD19靶向CAR-T疗法拟纳入突破性疗法认定。合源生物抗CD19嵌合抗原受体T细胞注射液(CNCT19)获CDE纳入拟突破性疗法认定公示名单,治疗复发或难治性急性淋巴细胞白血病(ALL)。CNCT19是具有中国自主知识产权的靶向CD19的CAR-T细胞治疗产品,是中国医学科学院血液病医院(血液学研究所)创制成果。目前CNCT19用于治疗非霍奇金淋巴瘤(NHL)适应症已进入II期临床,治疗ALL的适应症已完成I期临床研究。
国际药讯
1.辉瑞/BioNTech新冠疫苗获FDA紧急使用授权。FDA发布了首个新冠疫苗的紧急使用授权(EUA),允许辉瑞/BioNTech的mRNA新冠疫苗以2剂接种(间隔3周),用于在16岁及以上个体中预防新冠状病毒引起的COVID-19。支持EUA的有效性数据包括对正在进行的36,523名受试者进行的分析。该疫苗预防出现症状的COVID-19的有效率为95%。目前尚无数据确定疫苗将提供保护的持续时间,也没有证据表明疫苗可预防新冠病毒在人与人之间的传播。最常报告的不良事件为注射部位疼痛、疲倦等。
2.诺华PCSK9靶向药物获欧盟上市批准。诺华PCSK9靶向siRNA药物Leqvio(inclisiran)获欧盟委员会的批准,用于治疗成人高胆固醇血症及混合性血脂异常。这是这款长效降脂药的全球首批,Inclisiran 仅需每年皮下注射给药两次即可有效降低LDL-C的水平。在一项ORION临床中,对于使用最大耐受剂量的他汀治疗后LDL-C仍无法达标的患者,Inclisiran可使LDL-C下降达52%。该项研究成果今年早些时候已发表于《新英格兰医学杂志》上。
3.艾伯维JAK抑制剂治疗特异性皮炎达Ⅲ期终点。艾伯维JAK抑制剂Rinvoq(upadacitinib)治疗特异性皮炎的Ⅲ期临床获积极结果。与dupilumab对照组相比,upadacitinib治疗组16周后患者的湿疹面积严重指数达到EASI 75应答的患者比例更高(71%vs61%,p = 0.006)。值得一提的是,该疗法用于治疗溃疡性结肠炎的Ⅲ期临床也于昨天宣布达到主要终点指标。目前,upadacitinib正在接受监管部门的审评,有望在中重度活动性类风湿关节炎适应症之后,获批扩大适应症。
4.K药联合化疗治疗三阴乳腺癌最新数据公布。默沙东在SABCS2020年会上公布了有关Keytruda联合化疗药物治疗三阴性乳腺癌(TNBC)患者的最新III期临床KEYNOTE-355(NCT02819518)数据。Keytruda联合紫杉醇可使初治的转移性TNBC患者(PD-L1的综合阳性评分(CPS)至少为10)的疾病发展或死亡风险降低67%;Keytruda联合Abraxane或白蛋白结合型紫杉醇时,与单独化疗相比,加入Keytruda的治疗降低了43%的风险;当与吉西他滨/卡铂联用时,降低了23%的风险。今年11月,Keytruda已获FDA加速批准,可以与上述三种化疗方案中的任何一种一起使用。
5.阿斯利康/第一三共更新Enhertu治疗乳腺癌数据。阿斯利康与合作伙伴第一三共制药在SABCS2020年会上公布HER2靶向抗体偶联药物(ADC)Enhertu注册II期试验DESTINY-Breast01的最新结果。中位随访20.5个月时,Enhertu在先前接受过2种或多种HER2靶向方案的转移性乳腺癌患者中的ORR为61.4%、中位DOR为20.8个月、中位PFS为19.4个月。此外探索性分析结果显示,估计有74%的患者在18个月时仍然存活。Enhertu的总体安全性和耐受性与之前报道的一致。根据该试验的早期结果,Enhertu在美国和日本已获批用于治疗HER2阳性、不可切除或转移性乳腺癌。
6.阿斯利康将收购罕见病药物公司Alexion。阿斯利康宣布拟以总价为390亿美元收购Alexion公司。Alexion主要产品为两款C5补体抑制剂Soliris(eculizumab)和Ultomiris,Soliris在许多国家已获批用于治疗阵发性睡眠性血红蛋白尿症、非典型溶血性尿毒综合征、全身型重症肌无力和视神经脊髓炎谱系障碍患者;Ultomiris则是一款第二代C5单抗。此次收购后,两家公司研发团队将合作开发Alexion的11个分子的产品线,以及跨越适应症范围、罕见病和其他领域的20多个临床开发项目。收购预计于2021年第三季度结束。
医药热点
1.美国将开展首批290万剂新冠疫苗接种。根据美国约翰斯·霍普金斯大学统计数据,截至北京时间12月13日7时26分,美国新冠确诊人数超过1600万,达16035537人,死亡人数达297697人。从1500万例增至1600万例,美国用时仅4天。当地时间11日晚,FDA授予辉瑞/BioNTech新冠疫苗紧急使用授权。美国联邦政府已准备好首批290万剂疫苗,预计在几天内将开始给医护人员和疗养院的老人等注射疫苗。
2.河南拟提升基层呼吸系统疾病早期筛查和干预能力。河南省基层慢性呼吸系统疾病早期筛查干预能力提升项目日前正式启动。该项目总投资8500万元,覆盖全省17个省辖市、济源示范区和10个直管县(市)60%的基层医疗卫生机构和所有疾控中心,主要为基层医疗卫生机构配备统一标准的肺功能检测仪,完成相关人员慢性呼吸系统疾病防治培训,搭建河南省基层医疗卫生机构呼吸系统疾病监测管理平台等。
3.多地通知年底前完成医护电子证照申领。山西省卫健委日前发布通知,自12月10日起,要求各级各类医疗机构、医师、护士,要对各自电子化注册、电子证照申领等情况进行自查自纠。医疗机构、医师、护士必须于2020年12月30日前,完成电子化注册、电子证照申领。在非标准机构内注册的医师、护士,要于2020年12月30日前,将本人注册信息进行变更。除山西省外,深圳市卫健委也已发布相关紧急通知。
股市资讯
【九强生物】公司产品甘胆酸测定试剂盒,丙戊酸测定试剂盒,苯妥英测定试剂盒,卡马西平测定试剂盒(以上均为均相酶免疫法)获颁的《医疗器械注册证》,用于体外定量测定人血清中对应物质的含量。
【康泰生物】全资子公司“民海生物”的吸附无细胞百白破灭活脊髓灰质炎联合疫苗获得药物临床试验批准通知书,用于预防白喉、破伤风、百日咳和脊髓灰质炎,具有减少婴幼儿的接种针次,增强家长和婴幼儿接种的依从性等优势。
【天药股份】公司产品塞来昔布原料药通过CDE技术审评,该产品用于生产消炎、镇痛、退热药塞来昔布。2019年塞来昔布固体口服制剂全球销售额约11.2亿美元,原料药消耗量约为437吨。2019年塞来昔布胶囊中国销售额12.4亿元,2015至2019年年复合增长率达10.0%。
审评动向
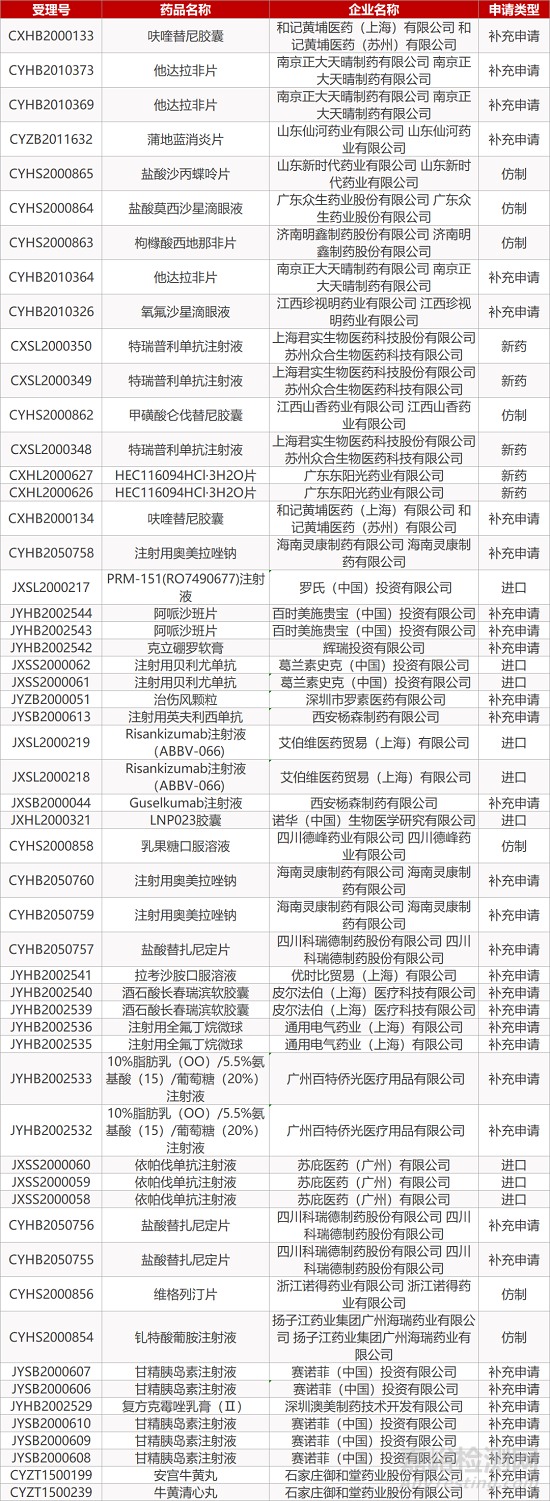
1. CDE最新受理情况(12月13日)
- The End -

来源:药研发


