您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2020-03-09 09:52
更多医药技术资讯,请点击医药专栏:http://drug.anytesting.com/ 欢迎关注文末微信公众号:药研检测drugtest
「本文共:16条资讯,阅读时长约:3分钟 」
阿斯利康Imfinzi膀胱癌III期试验失败。阿斯利康公司公布抗PD-L1疗法Imfinzi(英飞凡,durvalumab,度伐利尤单抗)治疗膀胱癌III期DANUBE试验的最新进展。在2017年5月,FDA加速批准Imfinzi治疗晚期膀胱癌患者,III期DANUBE试验作为与FDA达成协议的批准后承诺而开展。该研究评估Imfinzi单药、Imfinzi+抗CTLA-4疗法tremelimumab的疗效,并与标准护理(SoC、顺铂或卡铂+吉西他滨)化疗对比。结果显示,在高表达PD-L1(≥25%)患者中,与SoC化疗相比,Imfinzi单药未能改善患者OS;且无论PD-L1表达水平如何,Imfinzi+tremelimumab联合疗法也未能改善OS。该研究中,Imfinzi以及Imfinzi +tremelimumab组合的安全性和耐受性与以前的试验一致。
1.东阳光药奥司他韦美国获批上市。东阳光药抗流感药物磷酸奥司他韦胶囊(30mg、45mg、75mg)获FDA批准上市。奥司他韦是由吉利德研发,罗氏负责全球商业化的一款神经氨酸酶抑制剂,对甲型、乙型流感、H5N1、H9N2等亚型流感病毒引起的流行性感冒有治疗和预防的作用。该药于1999年获FDA批准上市,商品名为达菲。目前,奥司他韦已获批进口中国,罗氏已将其生产销售分别授权给上海医药和东阳光药,两家公司分别以商品名奥尔菲和可威上市销售。据悉,可威在中国的市场份额高达87.68%。
2.全球唯一的牙骨传导听力系统在中国获批。上海声佗医疗研发生产的SoundBite™/品音®牙骨传导听力系统获得国家药监局颁发的医疗器械注册证。SoundBite™/品音®牙骨传导听力系统是一种完全无创的穿戴式听力设备,主要由耳背机、口内机和充电系统组成。据悉,该听力系统能显著改善患者听力状况,提高其在安静及噪声下的言语识别能力,可作为成人单侧聋和传导性听力损失患者的听力解决方案之一。该产品同时也获得了FDA的批准,是目前全球唯一获批上市的牙骨传导听力系统。
3.多发性硬化药物特立氟胺片国内首家报产。南京海纳制药和盛世泰科联合申报的4类仿制药特立氟胺片的上市申请获CDE受理。特立氟胺 (teriflunomid) 是由赛诺菲研发的一种氢乳清酸脱氢酶抑制剂,2012年9月在美国获批用于治疗成人复发型多发性硬化(MS),商品名为 Aubagio,2013年9月获EMA 批准用于治疗成人复发-缓解型MS,2018年7月在国内获批用于治疗复发型MS,商品名为奥巴捷。目前,国内共有9家企业布局特立氟胺片市场,南京海纳制药特立氟胺片进展最快,处于上市申请阶段。
4.德琪ATG-010晚期非小细胞肺癌项目新进展。德琪医药选择性核输出蛋白抑制剂ATG-010在中国启动一项II期临床(CTONG1702)研究。该研究评估ATG-010对KRAS突变的晚期非小细胞肺癌(NSCLC)患者的有效性,广东省人民医院吴一龙教授为主要研究者。ATG-010具有广泛的抗肿瘤活性,目前正在多项临床研究中用于治疗多种实体肿瘤和血液肿瘤,其在中国开展的注册临床研究包括复发难治性多发性骨髓瘤以及弥漫性大B细胞淋巴瘤。ATG-010联合低剂量地塞米松治疗复发难治性多发性骨髓瘤已于去年7月获FDA加速批准。
5.GSK美泊利单抗在华获批临床。葛兰素史克IL-5抑制剂美泊利单抗注射液(mepolizumab,Nucala)获国家药监局临床试验默示许可,拟开发适应症为慢性阻塞性肺病(COPD)。Nucala是一款”first-in-class“全人源化白介素-5(IL-5)单抗药物,最早于2015年获得FDA的批准。值得一提的是,它是全球获批的首个靶向IL-5的生物疗法,同时也是首个获批用于治疗重度嗜酸性粒细胞性哮喘的IL-5单抗。目前GSK正在评估该药物用于治疗重度嗜酸性粒细胞增多症(HES)、鼻息肉病和COPD等。
6.华海药业HB0017项目在美获批临床。华海药业旗下华博生物HB0017项目获FDA临床试验批准。HB0017是一种抗IL-17单抗药物,拟用于治疗银屑病、银屑病关节炎和强制性脊柱炎。国外已上市同靶点(IL-17/IL-17 受体)药物包括Cosentyx(商品名:可善挺)、Taltz(商品名:拓咨)和 Siliq,国内除 Cosentyx、Taltz2已于2019年获批上市外尚无其他同靶点药物上市。Cosentyx2019年、Taltz2018年全球销售额分别为35.51亿美元和9.375亿美元。
1.全球首款非肝硬化性NASH的治疗药物在印度获批。印度药物管理局批准Zydus Cadila公司的PPARα/γ双重激动剂saroglitazar magnesium上市,治疗非肝硬化性非酒精性脂肪性肝炎(NASH)患者。这是世界首款获批治疗非肝硬化性NASH的药物。该药物此前在印度已获批治疗非他汀类药物无法控制的2型糖尿病患者的糖尿病血脂异常和高甘油三酯血症,以及用于2型糖尿病患者的治疗。在一项Ⅱ期临床EVIDENCES IV中,与安慰剂相比,saroglitazar magnesium使患者的肝脏丙氨酸转氨酶水平下降44.39%,此外,通过MRI-PDFF定量评估患者的肝脂肪含量也达到了统计学意义的显著降低。
2.艾尔建青光眼长效疗法获FDA批准。FDA批准艾尔建( Allergan)开发的前列腺素类似物Durysta(bimatoprost)上市,用于治疗开角型青光眼(OAG)或高眼压症(OHT)患者。Durysta是首款,也是唯一一款可被生物降解的持续释放植入物,可植入患者眼睛的前房室中,长期缓慢释放bimatoprost,有效降低患者的眼压。在两项Ⅲ期临床中,与活性对照组(timolol眼药水)相比,Durysta治疗组中患者的眼压被降低了30%,达非劣效性标准。且超过80%的患者可能在接受植入体之后1年内不需要接受其它治疗。
3.赛诺菲Cablivi获加拿大批准上市。加拿大卫生部批准赛诺菲选择性双价抗血管性血友病因子(vWF)纳米抗体Cablivi(caplacizumab),联合血浆置换和免疫抑制疗法,用于治疗获得性血栓性血小板减少性紫癜(aTTP)成人患者。在一项III期研究HERCULES(NCT02553317)中,与安慰剂+标准护理相比,Cablivi联合标准护理显著缩短血小板计数正常化的时间(p=0.01);Cablivi治疗组达到正常血小板计数的可能性是安慰剂组的1.55倍;Cablivi联合标准护理使疾病进展和死亡风险显著减少74%(p<0.001);Cablivi的安全性与先前报道一致。Cablivi是加拿大批准的首个专门治疗aTTP的药物。
4.全球第二款RNAi药物Givlaari获欧盟批准。欧盟委员会批准Alnylam制药公司siRNA药物Givlaari(givosiran)用于治疗12岁及以上青少年和成人的急性肝卟啉症(AHP)。在美国,Givlaari于2019年11月获得批准,用于治疗AHP成人患者。在一项III期ENVISION研究中,Givlaari达到主要终点和多个次要终点。与安慰剂相比,Givlaari治疗将AHP患者复合卟啉症发作的年发生率降低了74%;在6个月治疗期间,Givlaari组有50%患者没有发生复合卟啉症发作,安慰剂组仅为16.3%。
5.强效法尼基转移酶抑制剂tipifarnib获快速通道资格。FDA授予Kura Oncology公司高选择性法尼基转移酶抑制剂tipifarnib快速通道资格,用于治疗成人复发/难治性血管免疫母细胞性T细胞淋巴瘤(AITL)、滤泡性T细胞淋巴瘤(FTCL)、淋巴结外周T细胞淋巴瘤(TFH)。在ASH 2019年会上公布的最新临床数据显示,在先前已接受疗法数量中位数为3种的一个重度预治疗AITL患者群体中,tipifarnib单药的ORR约为50%;在KIR突变的患者中,tipifarnib的ORR为70%,完全缓解率为40%。
1.葛兰素史克CEO 2019年薪酬破千万美元。根据葛兰素史克近日发布的年度报告,2019年,该公司CEO Walmsley的总薪酬为837万英镑(约合1081万美元),同比增长超过42%,净赚250万英镑。增长主要来自于公司授予她的表现奖励(包括年终奖和LTI奖励),总额达683.7万英镑。2019年是Walmsley上任后的第一个三年绩效评估点。随着收购肿瘤创新研发公司、与辉瑞成立消费者健康合资企业,2019年葛兰素史克转型成功,其创新的产品销售(如Shingrix)和自由现金流均达到了最高目标。
2.中央明确防疫相关补助津贴向一线医务人员倾斜。3月5日,中共中央政治局常委、国务院总理、中央应对新冠肺炎疫情工作领导小组组长李克强主持召开领导小组会议。会议强调,要进一步落实好关心关爱医务人员各项措施,临时工作补助、一次性慰问补助、卫生防疫津贴等要及时发放,向与患者直接接触的接诊、筛查、检测、转运、治疗等一线医务人员特别是救治重症患者的医务人员倾斜,不得按行政级别确定发放标准。
3.沙利度胺救治重症新冠肺炎有效。据媒体报道,温医大附一院已在10例新冠肺炎患者的治疗中使用沙利度胺,使用后病人情况都有好转,效果十分显著。其背后的作用机制可能就是沙利度胺具有明显的免疫调节作用,可能会抑制患者细胞因子风暴的发生,平安度过致死性奇高的细胞因子风暴,抑制免疫,达到平稳度过危险期的目的。沙利度胺最早作为催眠镇静剂在欧洲获批上市,用于减轻怀孕前期呕吐反应(俗称:反应停/反应亭)。
4.4月部分疫苗有望进入临床或应急使用。国家卫健委医药卫生科技发展研究中心主任郑忠伟在6日下午的国务院联防联控机制新闻发布会上介绍,新冠肺炎疫情科研攻关组专门设立了疫苗研发专班,第一批筛选了8家机构,确立了9项任务,沿着5条技术路线推进疫苗攻关工作。预计在4月份,部分疫苗有望进入临床或者应急使用。
【翰宇药业】拟非公开发行不超过9.52亿元股票
【泽璟制药】盐酸杰克替尼片治疗中、重度斑块状银屑病患者Ⅱ期临床获批
【奥赛康】地拉罗司分散片和地拉罗司原料药(治疗慢性铁过载)生产注册获受理
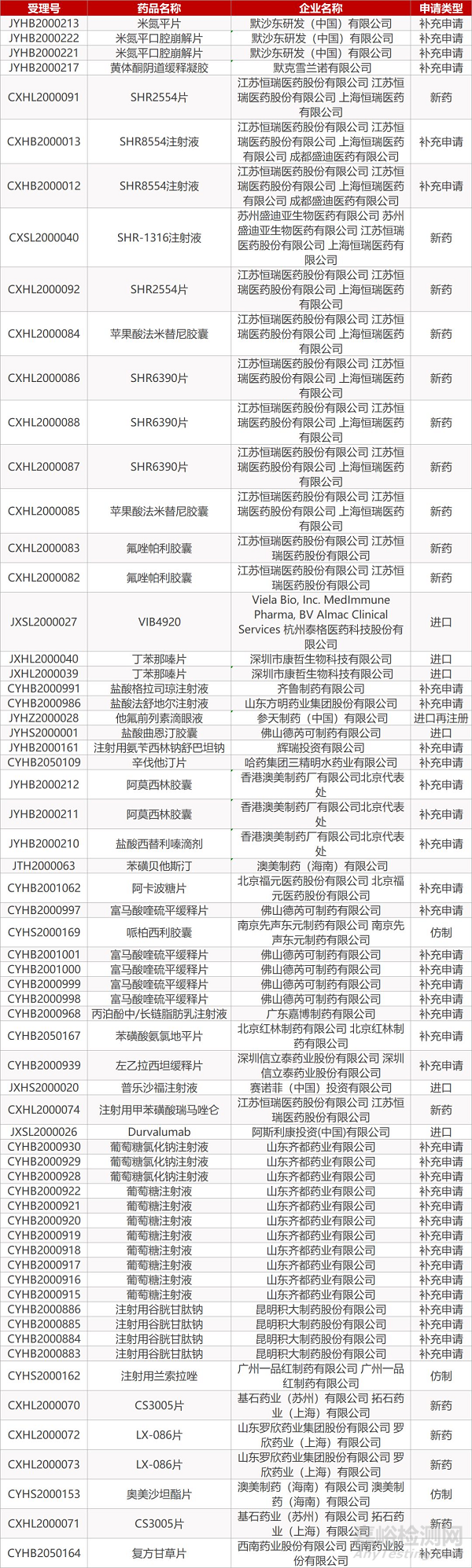
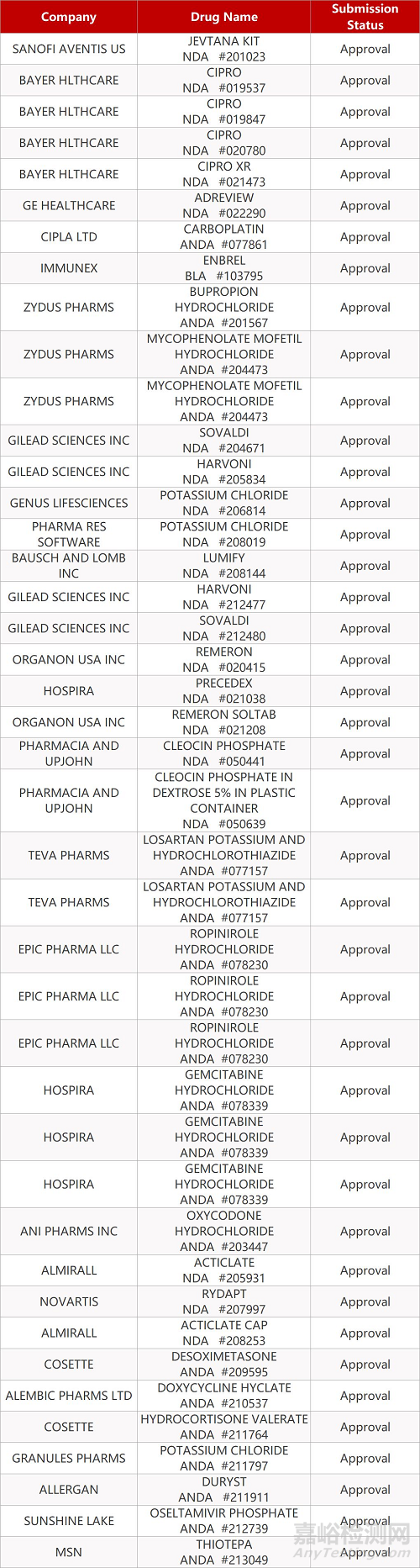
2. FDA最新获批情况(北美3月6日)
- The End -

来源:药研发


