您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2019-09-25 09:10
「本文共:16条资讯,阅读时长约:3分钟 」
今日头条
天境生物与默沙东开展TJC4与KEYTRUDA联合用药研究。天境生物创新的全人源CD47单克隆抗体TJC4与默沙东PD-1抑制剂 KEYTRUDA® (pembrolizumab)将联合开展治疗多种肿瘤的临床研究。该研究旨在评估TJC4和KEYTRUDA®的联合用药在多种癌症患者中的安全性、药代动力学、药效动力学及初步疗效。根据协议,两家公司将合作开展联合用药的Ⅰ期临床试验,试验方案由双方共同制定、确认;默沙东将向天境生物提供临床试验用的KEYTRUDA® 。
国内药讯
1.山香药业醋酸阿比特龙片获批。山香药业醋酸阿比特龙片的新4类上市申请获国家药监局批准,成为继恒瑞、正大天晴之后,该品种仿制药国内第3家获批的厂家。阿比特龙是一种细胞色素P450羟化酶抑制剂。其原研药由强生开发,最早于2011年4月在美国获批上市,商品名Zytiga,用于治疗前列腺癌。2015年5月该原研药已在中国获批上市,商品名泽珂。2018年强生的阿比特龙全球销售额为35亿美元。
2.百济神州公布多项替雷利珠单抗的临床数据。百济神州在CSCO大会上公布其PD-1抗体替雷利珠单抗三项临床试验结果。在替雷利珠单抗联合化疗一线治疗晚期肺癌的Ⅱ期临床中,结果显示ORR为 66.7%;在非鳞状NSCLC患者中的ORR为43.8%;在鳞状NSCLC患者(A组)中的ORR为80%;在鳞状NSCLC患者(B组)中的 ORR 为 66.7%;在SCLC患者中的ORR为76.5%。在替雷利珠单抗联合化疗一线治疗晚期食管、胃或食管胃交界部癌症的Ⅱ期临床中,结果显示7例患者达PR,ORR为46.7%;DoR为12.8 个月;中位PFS为10.4个月。在替雷利珠单抗单药治疗晚期实体瘤的Ⅰ/Ⅱ期临床中,结果显示替雷利珠单抗在晚期实体瘤患者中总体耐受,安全性良好。
3.亚虹医药膀胱癌新药中国Ⅲ期临床所有患者入组。亚虹医药在研抗癌药APL-1202治疗非肌层浸润性膀胱癌的中国Ⅲ期临床完成所有患者入组。该研究旨在评价APL-1202联合化疗膀胱灌注对比安慰剂联合化疗膀胱灌注治疗化疗灌注复发的中、高危非肌层浸润性膀胱癌的疗效和安全性。据悉,APL-1202是国际上首个进入临床研究的口服、可逆性甲硫氨酸氨基肽酶Ⅱ型(MetAP2)抑制剂,既抑制肿瘤细胞的生长,也抑制肿瘤血管新生。目前,APL-1202在美国也已进入临床研究阶段。
4.雅创医药NASH创新药HPG1860获FDA临床批件。雅创医药拟用于治疗非酒精性脂肪性肝炎(NASH)的自主原创新药HPG1860获FDA临床研究许可,即将在美国启动Ⅰ期临床研究。HPG1860是雅创自主研发,拥有全球知识产权的FXR激动剂,具有非胆汁酸结构、高效、高度选择性等特点。HPG1860的Ⅰ期临床主要评估健康志愿者经单次和多次口服后剂量递增的安全性,药代动力学以及药效动力学效应。
5.礼来IL-23抑制剂在华申报临床获受理。礼来IL-23抑制剂mirikizumab注射液的临床试验申请获国家药监局受理。Mirikizumab是一款靶向IL-23的p19亚基的全人源化单克隆抗体,目前,mirikizumab在多项临床试验中治疗包括银屑病、溃疡性结肠炎和克罗恩病在内的多项免疫疾病。一项治疗中重度克罗恩病患者的Ⅱ期临床结果显示,与安慰剂相比,mirikizumab在治疗12周后显著降低临床和内镜检测到的疾病活动。礼来计划在今年晚些时候启动该适应症的Ⅲ期临床试验。
6.启函生物完成A+轮融资。启函生物完成2550万美元A+轮融资。本轮融资由招银国际资本领投,A轮投资方红杉资本中国基金、北极光等持续跟投。启函生物于2018年7月获得A轮融资,至此完成A轮总融资金额合计3300万美元。启函生物由美国科学院和工程院双院院士、哈佛大学George Church教授和合成生物学家杨璐菡博士共同创立。该公司致力于使用世界先进的基因编辑技术生产出可用于人体移植的安全有效的细胞、组织和器官,解决中国和世界器官移植供体严重短缺的问题。
国际药讯
1.首个植物来源大麻素药物Epidyolex获欧盟批准。GW 公司Epidyolex(cannabidiol,大麻二醇,CBD)口服液体制剂获欧盟委员会批准,用于2岁及以上患者辅助治疗与Lennox-Gastaut综合征(LGS)和Dravet综合征(DS)相关的癫痫。Epidyolex是欧洲批准治疗癫痫的首个植物来源大麻素药物。4项III期临床结果显示,当添加至其他抗癫痫治疗中时,Epidyolex显著降低LGS和DS患者的癫痫发作频率;临床中最常见的不良反应是嗜睡、食欲减退、腹泻、发热、疲劳和呕吐。
2.强生多发性骨髓瘤药物Darzalex新适应症获批在即。9月26日,FDA将对强生开发的Darzalex(daratumumab)联合标准护理(硼替佐米+来那度胺+低剂量地塞米松,VTd)一线治疗适合自体干细胞移植的多发性骨髓瘤(MM)患者的补充生物制品许可申请作出审查决定。Darzalex有望将再次斩获MM治疗领域又一个一线疗法适应症。Darzalex是全球获批的首个针对肿瘤浆细胞表面的CD38分子、人源化免疫球蛋白IgG1单克隆抗体,最初由Genmab开发,2012年强生通过授权获得其全球独家权利。目前Darzalex已获批MM治疗领域的多项适应症,从最初的四线疗法扩大到一线疗法。2019年上半年Darzalex 的全球销售额约14.03亿美元。
3.礼来度拉鲁肽欧盟标签将更新。礼来宣布,欧洲药管局人用医药产品委员会(CHMP)发布积极意见,建议更新每周一次胰高血糖素样肽-1受体激动剂(GLP-1RA)降糖药Trulicity(dulaglutide,度拉鲁肽)的标签和适应症声明。CHMP认为,Trulicity的药物标签中应纳入来自治疗2型糖尿病患者的心血管(CV)预后研究REWIND的结果,数据显示:与安慰剂相比,Trulicity将主要不良心血管事件(MACE)风险显著降低12%,在伴或不伴CV疾病的患者中具有一致的MACE效应,在整个研究过程中,CV风险持续降低。此外,更新后的标签将反映Trulicity在横跨主要人口和疾病亚组中对MACE风险降低的一致性。
4.Neurana公布STAR研究积极数据。Neurana公司开发的托勒哌松治疗背部急性肌肉痉挛的Ⅱ期临床(STAR研究)获积极结果。该研究旨在评估托哌酮不同的每日剂量的疗效,以确定Ⅲ期临床的计划剂量。结果表明600毫克剂量的托哌酮疗效显着(p = 0.004),且嗜睡性与安慰剂相似。在STAR研究中,托哌酮的耐受性良好,大多数不良事件为轻中度,研究期间未报告严重不良事件。Neurana计划在2020年第一季度与FDA进行第二阶段会议,并在2020年下半年启动Ⅲ期临床研究。
5.Annexon公司创新补体抑制剂获快速通道资格。Annexon公司开发的补体抑制剂ANX005获FDA授予治疗格林-巴利症候群(GBS)患者的快速通道资格。此前,FDA已授予ANX005孤儿药资格。ANX005是靶向C1q的人源化单克隆抗体,主要用于阻断人体免疫早期补体级联过程中关键的蛋白质C1q。它可以阻断整个经典途径的活化,并保持其它补体途径功能的完整性。ANX005通过C1q有效阻止神经性病变,治疗患有GBS的患者。此外,Annexon公司还在其他自身免疫和神经退行性疾病中评估ANX005的治疗潜力。
6.Clovis公司与3BP公司达成一项研发合作。Clovis公司与专注于开发癌症放射性疗法的3B Pharmaceuticals(3BP)公司签订一项合作协议,利用3BP公司成纤维细胞活化蛋白α(FAP)成像剂技术与肽受体放射性核素疗法(PTRT)相结合,联合开发一款靶向FAP的放射性药物。FAP在多种恶性肿瘤类型中高度表达。根据协议,3BP公司将获约1200万美元的预付款以及潜在里程碑付款;Clovis公司获3BP公司靶向FAP放射性药物以及PTRT在欧洲以外大多数国家的独家权益。此外,双方还计划开发另外三款放射性核素药物。
医药热点
1.八大行动助力癌症防治。国家卫健委等10部门共同发布《健康中国行动——癌症防治实施方案(2019~2022年)》,提出到2022年,我国癌症发病率、死亡率上升趋势得到遏制,总体癌症5年生存率比2015年提高3个百分点,患者疾病负担得到有效控制。为此,《实施方案》部署开展八大行动。这八大行动分别是危险因素控制行动、癌症防治能力提升行动、癌症信息化行动、早诊早治推广行动、癌症诊疗规范化行动、中西医结合行动、保障救助救治行动和重大科技攻关行动。
2.山东知名专家出诊有了规范。山东省卫健委、医保局印发《山东省公立医疗机构知名专家诊察费管理办法》,对知名专家入选条件作出具体规定,并对知名专家号挂号费、服务时间、接诊人次进行规范。《办法》明确,知名专家诊察费价格由公立医疗机构自主制定;知名专家诊察费价格要及时向同级卫生健康、医保部门备案;知名专家诊察费不纳入基本医疗保险基金支付范围;知名专家每周服务时间不超两次(每次半天),每次接诊原则上不超过20人次。
3.辽宁合力救助血液病和恶性肿瘤患儿。辽宁省卫健委等多部门联合推出《转发关于开展儿童血液病、恶性肿瘤医疗救治及保障管理工作的通知》,明确建立定点医院及诊疗协作网络、成立省级专家组加大培训等手段,合力救助血液病和恶性肿瘤患儿。目前,辽宁已确定中国医科大学附属盛京医院和大连市儿童医院2家省级和6家市级儿童血液病定点医院。此外,该省还加快推进落实全民参保计划,确保全省儿童全面参加城乡居民医保。加大再生障碍性贫血等10种儿童血液病、恶性肿瘤的大病保险倾斜力度,大病保险起付线降至50%,支付比例提高到70%,不设封顶线。
【白云山】分公司白云山制药总厂的产品盐酸美金刚片获药品注册批件。
【双成药业】公司承担的国家科技重大专项项目(课题)“糖尿病治疗药物艾塞那肽的试生产研究”及“急性心肌梗死治疗药物依替巴肽的试生产研究”,已顺利通过国家卫生健康委医药卫生科技发展研究中心验收。
审评动向
1. CDE最新受理情况(09月24日)
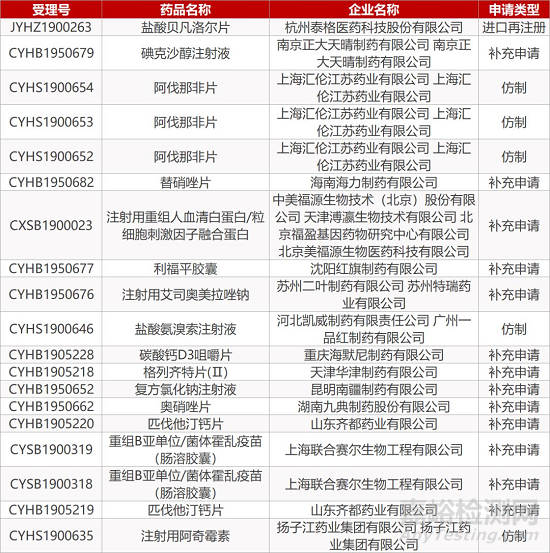
2. FDA最新获批情况(北美09月23日)
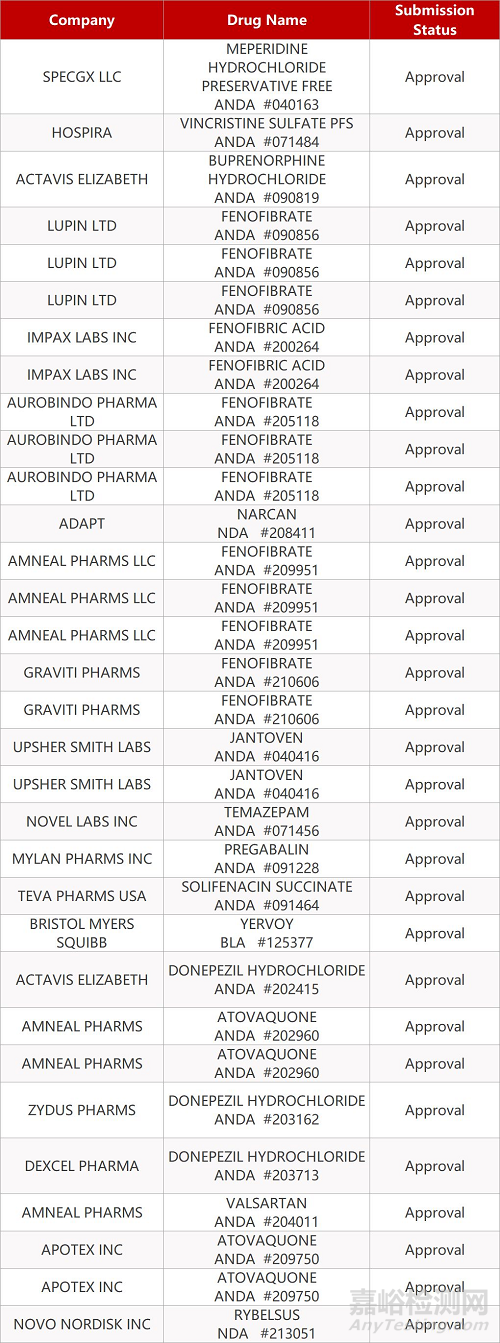

来源:药研发


