近日,器审中心发布了上海微创心通医疗科技股份有限公司的经导管主动脉瓣膜系统医疗器械产品注册技术审评报告,从这份报告中,我们可以了解经导管主动脉瓣膜系统在研发阶段需要做哪些检测实验。
医疗器械产品注册技术审评报告
产品中文名称:经导管主动脉瓣膜系统
产品管理类别:第三类
申请人名称:上海微创心通医疗科技股份有限公司
产品审评摘要
一、产品概述
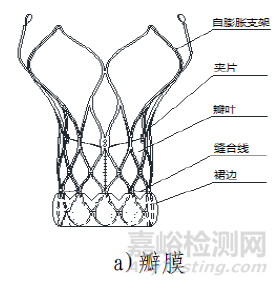
(一)产品结构及组成
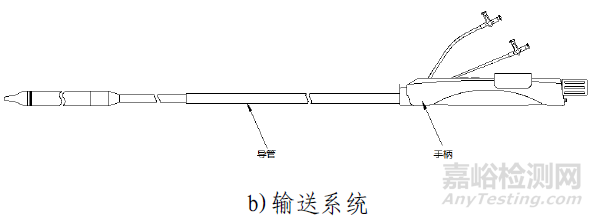
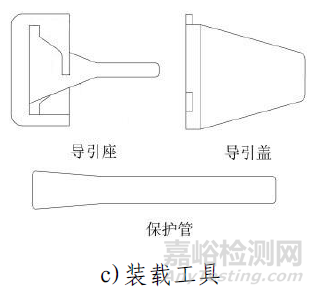
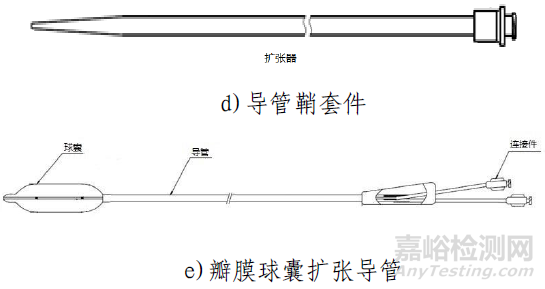
该产品由主动脉瓣膜、输送系统、装载工具、导管鞘套件以及瓣膜球囊扩张导管组成。使用时主动脉瓣膜瓣膜通过装载工具被装载进输送系统中,导管鞘套件和可用于瓣膜预扩张/后扩张的瓣膜球囊扩张导管作为配套的附件。主动脉瓣膜由三片瓣叶(牛心包)、裙边(PET)、夹片(镍钛合金)与自膨胀支架(镍钛合金)通过缝合线(PTFE)缝合而成。输送系统主要由导管和手柄组成,含电池。导管鞘套件主要由导管鞘和扩张器组成。装载工具包括导引座、导引盖、保护管。瓣膜球囊扩张导管由非顺应性球囊和导管以及连接件部件组成。主动脉瓣膜经化学液体灭菌,输送系统、装载工具、导管鞘套件以及瓣膜球囊扩张导管均经环氧乙烷灭菌。主动脉瓣膜货架有效期为12个月;输送系统(不含电池)、装载工具、导管鞘套件有效期为24个月;电池有效期为6个月;瓣膜球囊扩张导管有效期为36个月。主动脉瓣膜在10-25℃条件下储存和运输。
(二)产品适用范围
该产品适用于经心脏团队结合评分系统评估后认为患有有症状的、钙化的、重度退行性自体主动脉瓣狭窄,不适合接受常规外科手术置换瓣膜、年龄≥70岁的患者。
(三)型号/规格
产品的型号规格参见表1
(四)作用机理
本产品包括瓣膜、输送系统、装载工具、导管鞘套件和瓣膜球囊扩张导管五个部分。
a)瓣膜、输送系统、装载工具
产品采用微创介入治疗方法,使用前通过装载工具将瓣膜装载进输送系统内;使用时在医学影像设备的监护下,通过建立好的血管通路将输送系统推送至主动脉根部位置,操作输送系统手柄完成瓣膜的释放,将瓣膜固定在主动脉瓣环处,代替功能退化的瓣膜,使病人主动脉瓣功能得到改善。
b)瓣膜球囊扩张导管
瓣膜球囊扩张导管用于原生瓣膜预扩张以及经导管主动脉瓣膜植入后的后扩张。产品通过导丝推送至主动脉瓣环位置。注射器通过鲁尔接口向通液腔中打入液体,使球囊充盈,从而完成预扩张和后扩张。
c)导管鞘套件
导管鞘套件用于手术过程中创建进入血管的经皮穿刺通道。
二、临床前研究摘要
(一)产品性能研究
1.产品技术要求研究
技术要求研究项目如表2所示:
技术要求研究摘要
研究项目
1、瓣膜
尺寸
材料要求
外观
裙边缝合力
瓣膜流体力学性能
局部抗挤压
抗移位性
植入短缩率
径向支撑力
慢性向外力
裙边瓣叶支架连接强度
瓣叶破裂强度
裙边破裂强度
金属支架腐蚀敏感性
金属支架相变温度Af点
可视性
耐久性
支架疲劳性
MRI相容性
还原物质
重金属
酸碱度
蒸发残渣
紫外吸光度
戊二醛残留
无菌
细菌内毒素
热皱缩温度
瓣叶断裂力
瓣叶缝合力
渗漏量
孔隙率
扩张短缩率
长度变化率
甲醛残留
乙醇残留
异丙醇残留
2、输送系统
尺寸
外观
可视性
断裂力
扭转强度
无泄漏
耐腐蚀性
座
水合性
止血性
排空性
导丝通过性
瓣膜安装性
瓣膜系统的过鞘性能
瓣膜与输送系统连接强度
弯曲/扭结
推送性
追踪性
释放准确性
释放时间
撤除性能
扭转能力
扭转性
扭转结合强度
推送力
释放力
手柄扭矩
导管绝缘电阻
手柄绝缘电阻
电气安全要求
电磁兼容性要求
电气设备环境要求
还原物质
重金属
酸碱度
蒸发残渣
紫外吸光度
环氧乙烷残留
无菌
细菌内毒素
3、导管鞘套件
尺寸
外观
可视性
座
断裂力
导丝通过性
导管鞘无泄漏
导管鞘止血阀无泄漏
耐腐蚀性
扭转强度
止血性
水合性
还原物质
重金属
酸碱度
蒸发残渣
紫外吸光度
环氧乙烷残留
无菌
细菌内毒素
4、装载工具
尺寸
2.3.2 外观
还原物质
重金属
酸碱度
蒸发残渣
紫外吸光度
环氧乙烷残留
无菌
细菌内毒素
5、瓣膜球囊扩张导管
尺寸
外表面
末端圆滑性(尖端构形)
连接件
导丝腔爽滑性
无泄漏
断裂力
射线可探测性
耐腐蚀性
球囊爆破压
疲劳性能
穿越性能
回抽时间
水合性
球囊顺应性
还原物质
重金属
酸碱度
蒸发残渣
紫外吸光度
环氧乙烷残留
无菌
细菌内毒素
2.产品性能评价
产品性能评价包括瓣膜的重量,连接强度,包装性能,支架尺寸保持性,瓣膜弯曲性,瓣膜与主动脉根部适应性,输送系统的器械标识,电池容量,防水性,包装性能,排空性,瓣膜系统排空性,推送力,释放准确性等性能验证,并对瓣膜的清洗过程,瓣叶裁剪过程,瓣膜缝合过程,溶液配制过程,瓣膜抗钙化过程,瓣膜灭菌过程,瓣膜封装过程等工艺进行了验证,结果表明产品符合设计输入要求。
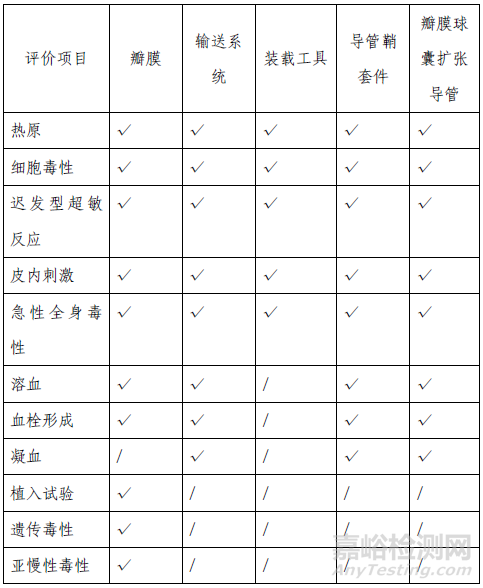
(二)生物相容性
该产品包含括瓣膜、输送系统、装载工具、导管鞘套件和瓣膜球囊扩张导管五个部分,其中瓣膜为植入器械,与循环血液长期接触;输送系统、导管鞘套件和瓣膜球囊扩张导管为外部接入器械,与循环血液短期接触。装载工具与人体间接接触。申请人按照GB/T 16886 系列标准对所有部件分别进行了生物相容性评价,产品的生物相容性风险可接受,具体评价项目详见表3。
表3 生物相容性评价项目表
(三)生物安全性
该产品的瓣膜部分采用了牛心包。申请人从原材料选取、原材料获取、原材料和供应商管控、生产过程管控、产品处理工艺方法控制、质量体系保证等方面进行了论述,并参照标准GB/T 16886.20和动物源性医疗器械注册技术审查指导原则等要求对瓣膜的抗钙化,免疫原和病毒灭活的性能进行了验证,结果符合要求,相关生物安全性风险可控。
(四)灭菌
该产品包含括瓣膜、输送系统、装载工具、导管鞘套件和瓣膜球囊扩张导管五个部分。其中瓣膜部分采用了化学灭菌方法,剩余的部件均采用环氧乙烷灭菌,无菌状态提供。申请人提供了灭菌过程确认报告,证明无菌保证水平为10-6。
环氧乙烷残留量不应大于10μg/cm2(其中输送系统不应大于4mg/件)。
(五)产品有效期和包装
瓣膜有效期为12个月;输送系统(不含电池)、装载工具、导管鞘套件有效期为24个月;电池有效期为6个月;瓣膜球囊扩张导管有效期为36个月。申请人提供了货架有效期验证报告。其中瓣膜、电池验证实验为实时老化,包括产品稳定性、包装完整性和运输模拟验证;输送系统、装载工具(不含电池)、导管鞘套件以及瓣膜球囊扩张导管验证实验为加速老化和实时老化,包括产品稳定性、包装完整性和运输模拟验证。
(六)动物研究
申请人开展了猪模型以及羊模型的动物实验研究以验证产品使用性能及安全性。评价指标包括有效性指标(瓣膜假体的急性功能、输送系统的急性性能以及瓣膜假体的短期、中期和长期血液动力学性能)和安全性指标(瓣膜假体的长期生物学反应)。动物实验结果表明,产品达到预期设计要求。
三、临床评价摘要
(略)