您当前的位置:检测资讯 > 法规标准
嘉峪检测网 2019-04-29 17:35
药品信息化追溯体系建设导则
(国家药品监督管理局2019年4月19日发布实施)
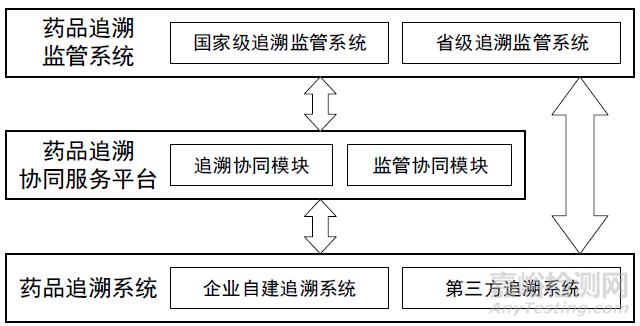
药品信息化追溯体系基本构成
1 范围
本标准规定了药品信息化追溯体系建设基本要求和药品信息化追溯体系各参与方基本要求。 本标准适用于药品上市许可持有人、生产企业、经营企业(包括批发企业和零售企业)、使用单位、发码机构及监管部门等追溯参与方协同建设药品信息化追溯体系。
2 规范性引用文件
下列文件对于本文件的应用是必不可少的。凡是注日期的引用文件,仅注日期的版本适用于本文件。 凡是不注日期的引用文件,其最新版本(包括所有的修改单)适用于本文件。
NMPAB/T 1002-2019 药品追溯码编码要求
3 术语和定义
3.1药品信息化追溯体系 drug traceability information system
药品上市许可持有人、生产企业、经营企业、使用单位、监管部门、消费者等药品追溯参与方,通 过信息化手段,对药品生产、流通、使用等各环节的信息进行追踪、溯源的有机整体。
3.2药品追溯协同服务平台 drug traceability harmonizationservice platform
通过提供不同药品追溯系统的访问地址解析、药品追溯码编码规则的备案和管理,以及药品、企业 基础数据分发等服务,辅助实现药品追溯相关信息系统互联互通的信息服务系统。
3.3药品追溯码 drug traceability code
用于唯一标识药品各级销售包装单元的代码,由一列数字、字母和(或)符号组成。
3.4药品标识码 drugidentification code
用于标识特定于某种与药品上市许可持有人、生产企业、药品通用名、剂型、制剂规格和包装规格 对应的药品的唯一性代码。
3.5生产标识码 productionidentification code
用于识别药品在生产过程中相关数据的代码。
4 药品信息化追溯体系建设基本要求
4.1 基本构成及其功能要求
4.1.1 基本构成
药品信息化追溯体系应包含药品追溯系统、药品追溯协同服务平台(以下简称协同平台)和药品追 溯监管系统。药品信息化追溯体系基本构成参见附录A。
4.1.2 药品追溯系统
应包含药品在生产、流通及使用等全过程追溯信息,并具有对追溯信息的采集、存储和共享功能, 可分为企业自建追溯系统和第三方机构提供的追溯系统两大类。
4.1.3 协同平台
应包含追溯协同模块和监管协同模块,追溯协同模块服务企业和消费者,监管协同模块服务监管工 作。应可提供准确的药品品种及企业基本信息、药品追溯码编码规则的备案和管理服务以及不同药品追 溯系统的地址服务,辅助实现不同药品追溯系统互联互通。
4.1.4 药品追溯监管系统
包括国家和各省药品追溯监管系统,根据各自监管需求采集数据,监控药品流向,应包含追溯数据 获取、数据统计、数据分析、智能预警、召回管理、信息发布等功能。
4.2 系统(平台)数据交换要求
药品追溯系统、协同平台、药品追溯监管系统之间的数据交换应符合国家药品监督管理局制定的数 据交换相关技术标准。
4.3 系统(平台)建设安全性要求
4.3.1 用户安全访问
应提供用户的身份注册、验证和统一管理功能;应提供用户认证、权限管理与访问控制功能。
4.3.2 数据安全传输
应提供数据接入验证功能,以确保数据接收的有效性;应提供数据传输过程中的隐私保护和防篡改 功能。
4.3.3 数据安全存储
应采用有效的数据安全存储技术,防止数据泄露;应能够验证存储数据的完整性和有效性,防止非 授权用户非法获取及修改数据,记录授权用户对数据的修改行为及内容;应具备数据备份与容灾功能。
4.3.4 系统(平台)安全管理
应提供日志和安全事件的管理及分析功能,可统计安全事件的相关情况,可按不同条件快速查询系 统、统计分析系统(平台)的日志和事件。
5 药品信息化追溯体系参与方构成及基本要求
5.1 参与方构成
药品信息化追溯体系参与方主要包括:药品上市许可持有人、生产企业、经营企业、使用单位、监 管部门和社会参与方。
5.2 参与方基本要求
5.2.1 总体要求
5.2.1.1 药品信息化追溯体系参与方要按照有关法规和标准,积极参与药品信息化追溯体系的建设和 维护。
5.2.1.2 药品上市许可持有人和生产企业承担药品追溯系统建设的主要责任,可以自建药品追溯系统, 也可以采用第三方技术机构提供的药品追溯系统。药品经营企业和药品使用单位应配合药品上市许可持 有人和生产企业建设追溯系统,并将相应追溯信息上传到追溯系统。
5.2.1.3 药品上市许可持有人、生产企业、经营企业和使用单位应当按照质量管理规范要求对相关活 动进行记录,记录应当真实、准确、完整、防篡改和可追溯,并应按照监管要求,向监管部门提供相关 数据,追溯数据字段应符合追溯基本数据集相关技术标准的规定。药品追溯数据记录和凭证保存期限应 不少于五年。
5.2.2 药品上市许可持有人和生产企业
5.2.2.1应根据《药品追溯码编码要求》对其生产药品的各级销售包装单元赋码,并做好各级销售包 装单元药品追溯码之间的关联。在赋码前,应向协同平台进行备案,服从协同平台统筹,保证药品追溯 码的唯一性。
注:备案内容主要包括:药品追溯码发码机构基本信息、编码规则、药品标识码及其相关信息(生产企业、药品通 用名、剂型、制剂规格、包装规格及该药品对应的药品追溯系统服务地址等)。
5.2.2.2 在销售药品时,应向下游企业或医疗机构提供相关追溯信息,以便下游企业或医疗机构验证 反馈。
5.2.2.3 应能及时、准确获得所生产药品的流通、使用等全过程信息,并应按照监管要求,向监管部 门提供相关数据。
5.2.2.4 应通过药品追溯系统为消费者提供药品追溯信息查询,查询内容应符合药品追溯消费者查询 信息基本数据集相关标准要求。
5.2.3 药品经营企业
5.2.3.1 药品批发企业在采购药品时,应向上游企业索取相关追溯信息,在药品验收时进行核对,并 将核对信息反馈上游企业;在销售药品时,应向下游企业或使用单位提供相关追溯信息。
5.2.3.2 药品零售企业在采购药品时,应向上游企业索取相关追溯信息,在药品验收时进行核对,并 将核对信息反馈上游企业;在销售药品时,应保存销售记录明细,并及时更新售出药品的状态。
5.2.4 药品使用单位
药品使用单位在采购药品时,应向上游企业索取相关追溯信息,在药品验收时进行核对,并将核对 信息反馈上游企业;在销售药品时,应保存销售记录明细,并及时更新售出药品的状态。
5.2.5 药品监管部门
5.2.5.1 国家药品监管部门应建设协同平台,提供准确的药品品种及企业基本信息、药品追溯码编码 规则的备案和管理服务以及不同药品追溯系统的地址服务,为药品追溯系统互联互通提供支持。
5.2.5.2 国家级和省级药品监管部门应建设药品追溯监管系统,根据各自监管需求采集其行政区域内 药品追溯相关数据,充分发挥追溯数据在日常监管、风险防控、产品召回、应急处置等监管工作中的作 用。
5.2.6 社会参与方
信息技术企业、行业组织等可作为第三方,按照有关法规和标准提供药品追溯专业服务。有关发码 机构应有明确的编码规则,并协助药品上市许可持有人和生产企业将其基本信息、编码规则、药品标识 码及相关信息向协同平台备案,确保药品追溯码的唯一性。

来源:国家药监局


