您当前的位置:检测资讯 > 法规标准
嘉峪检测网 2018-12-01 16:32
乳房植入体作为一种重要的植入性整形医疗器械,其安全性和有效性直接影响着受术者的生活质量。乳房植入体给受术者带来整形受益的同时,也带来了发生相关并发症的风险,如可能造成植入体破裂、人体组织挛缩、感染、钙化、错位、挤出、皮肤侵蚀、坏死、伤口愈合迟缓、团块形成、血肿、血清肿、疼痛、褶皱、不对称、瘢痕形成、医源性损伤、淋巴结病、结缔组织病等。因此,相对于有效性来说,乳房植入体的安全性在审评中是更加关注的。近几年来,一种名为“间变大细胞淋巴瘤”的罕见恶性肿瘤与植入乳房植入体之间的联系逐渐引起广泛关注,本文将对我们所了解到的这一罕见并发症的背景信息和审评相关情况进行介绍。
一、乳房植入体相关间变大细胞淋巴瘤
(一)概述
乳房植入体相关间变大细胞淋巴瘤(Breast Implant-Associated Anaplastic Large Cell Lymphoma ,BIA-ALCL)是一种罕见的免疫系统恶性肿瘤,目前被认为是T细胞淋巴瘤,属于非霍奇金淋巴瘤亚型的一种。主要症状为植入体或纤维薄膜周围的迟发性血清肿引起乳房肿胀,也有少部分病例表现为乳房实体肿块,两者可同时出现,可伴随周围淋巴结肿大。BIA-ALCL细胞表面分子特点提示其为激活的细胞毒性T细胞,CD30+为最普遍的分子标志物;表面ALK缺失,细胞核与ACK+、ACK-淋巴瘤细胞(同属非霍奇金淋巴瘤)类似表现为奇怪的马靴形状。但与其他类型的ALCL不同,BIA-ALCL侵袭性较低,很少侵犯乳房以外的组织。
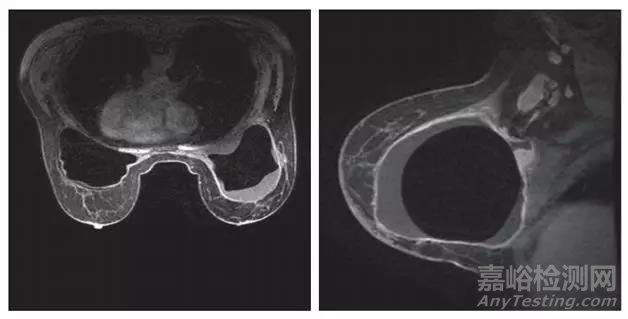
图1.MRI显示,乳房植入体周围被液体包裹,伴随右侧腋淋巴结肿大[1]。
(二)对BIA-ALCL的认识过程
1997年Keech JA Jr首次报道在盐水填充乳房植入体周围发现T细胞淋巴瘤的案例。
2011年,美国FDA宣布,女性植入硅胶植入体与ALCL发病可能存在潜在联系。美国FDA根据1997年-2010年发表的文献、其他国家的监管机构和生产厂家的信息和数据进行评估,推测当时全球约有500-1000万名女性接受过植入性隆胸手术,大约有60名置入乳房植入体的女性患有ALCL,因文献报道可能存在病例重复,以及可能存在未确诊患者,所以这一数据并不准确。
为了监测硅胶乳房植入体置入后的各种反应,明确危险因素,2014年美国FDA联合美国整形外科协会(ASPS)、 整形外科医生基金会(the Plastic Surgeons Foundation ,PSF)、制造商和患者群体建立了全国乳房植入物注册处(the National Breast Implant Registry,(NBIR)以及患者资料登记处(PROFILE Registry,用以收集潜在BIA-ALCL病例)。FDA针对MemoryGel® 硅胶植入体开展了长达十年的大型上市后队列研究(Large PAS),纳入41900位接受MemoryGel®的患者和1000位盐水假体患者。但因随访困难,且PAS队列研究对于评价罕见不良事件并无额外帮助。该研究最终被提前终止。[2]
2016年,WHO认定BIA-ALCL为一种与乳房假体置入相关的T细胞淋巴瘤。同年,美国国家综合癌症网络(the National Comprehensive Cancer Network ,NCCN)建立了对于BIA-ALCL诊治的共识,将BIA-ALCL作为非霍奇金淋巴瘤进行诊治:通过超声、核磁、细胞组织化学、渗出物CD30 IHC流式细胞学检查等手段,确诊BIA-ALCL,并向PROFILE registry(www.thepsf.org/PROFILE)汇报确诊病例。治疗方面,对于早期局部发病的患者,每半年行超声或CT观察病情,或行植入物取出、纤维包膜全切术,根据情况进行乳房重建。对于进展期患者,除外科切除外,可能还需合并辅助化疗、靶向治疗,病变无法完全切除的考虑视频治疗。[3]这一观点也获得了美国整形外科协会(ASPS)和美国美容整形外科学会(ASAPS)认可。
2017年3月,美国FDA在官网发布声明,确定乳房植入体与BIA-ALCL的相关性。
(三)现有数据
FDA、WHO以及多国监管机构的相关举措引起社会对BIA-ALCL的广泛关注,随着对BIA-ALCL认识的积累,每年报道文献数和发病率呈上升趋势。但由于病例数有限、可能存在重复报道,对文献的系统性分析并未能很好地对相关危险因素做出分析。[4]
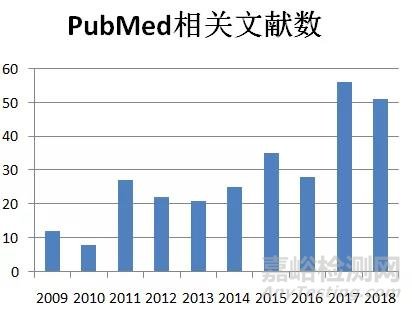
图2. PubMed检索到2009年以来与BIA-ALCL相关的文献数目,检索策略breast AND (implant* OR prosthesis OR prosthes* OR endoprosthes*) AND lymphoma*year,count。
至2017年9月30日,FDA共收到414例BIA-ALCL MDR报道(亚裔患者数极少,非裔患者暂无报道),其中9例死亡,有文献估计发病率在1/3,000,000至1/5,000,000之间。[5]该病发病时间为术后4个月至44年不等,平均发病时间位植入体置入术后7-8年。414例报道中,其中272例包含假体表面信息:242例为毛面,30例为光面。412例包含内容物信息:234例为硅凝胶假体,179例为盐水假体。不同使用目的(隆乳和重建)的患者之间发病率无明显差异。现有病例提示BIA-ALCL很少侵犯乳房以外的组织,实体病变比血清肿病变侵袭性更强,但总体预后较好。
我国目前尚无BIA-ALCL的病例报道。
(四)发病机理
目前,BIA-ALCL的发病机制尚不明确。人口学数据提示可能存在易感人群。大多数数据提示毛面假体的BIA-ALCL的发生率大大高于光面假体,目前最受认同的理论是刺激性因子导致慢性炎症,引发T细胞增生异常,对于毛面假体引发局部慢性炎症、刺激免疫细胞变异、增生的原因,目前有以下几种推测:
1.毛面假体与周围组织摩擦更大,引发周围组织炎症;
2.毛面假体周围更容易发现带菌性慢性炎症,细菌生物膜可能与该病存在联系;
3.毛面脱落小颗粒硅胶,引发周围组织炎症反应,硅胶和细菌同时存在时,硅凝胶协同细菌提呈抗原,进一步诱发免疫细胞异常增殖。
由于病因和易感因素并不明确,所以尚没有公认的预防措施。
二、目前各界采取的应对措施:
美国FDA对于BIA-ALCL采取了一系列措施:要求在产品包装上增加BIA-ALCL风险的文字性提示;同时通过MDR、文献报道、PROFILE Registry、真实世界等多种途径继续收集数据,从而进一步评价BIA-ALCL。对于患者,FDA建议患者术前应了解关于乳房植入体的基本知识、可能的风险,并提出了5个小贴士[6]:
1.乳房假体并非可以使用终身,只有少数患者能保持初次放置的假体20-30年。
2.阅读产品标签,了解SSED(Summary of Safety and Effectiveness Data——包含适用范围、风险、警告、注意事项、相关研究,以及严重并发症的发病时间。
3.与外科医师沟通。
4.了解长期风险,如BIA-ALCL、结缔组织疾病风险。
5.了解监视随访的重要性。
中华医学会整形外科学分会、中国整形美容协会、中国整形医师协会的相关专家于2017年5月7日在上海联合召开专题会议,达成对BIA-ALCL的共识:对于已置入植入体的患者目前不建议进行广泛筛查或取出植入体,应正常按期体检。虽然BIA-ALCL较为罕见,对于拟放置植入体的患者,术前应告知BIA-ALCL的风险,对于有可疑症状的患者,应引起高度重视,行影像学检查、引流积液并进行免疫组化检查,诊断应由血液科、病理科医生在内的多学科共同作出,对于再次手术的患者,应对植入体包膜和植入体周围肿块做病理学检查。[7]
三、乳房植入体产品注册申报时建议关注的内容
现在我国境内批准上市的乳房植入体产品均为以硅橡胶材料为外壳、硅凝胶材料为填充物的植入体,包含了毛面及光面的产品。目前在该类产品注册及延续注册申报资料中,尚未见到关于BIA-ALCL相关不良反应的报道。虽然该疾病发病率低,我国尚未有相关病例报道,但仍引起审评的重视。因此,在乳房植入体产品注册申报时,建议申请人关注以下几个方面的内容:
1.建议申请人提供关于BIA-ALCL的风险分析和防范措施相关资料;
2.建议申请人在说明书中增加BIA-ALCL的相关警示信息,依据所提供的研究资料结果按照YY 0647的要求明确乳房植入体预期寿命的信息;
3.鉴于目前的临床数据显示使用毛面植入体BIA-ALCL发病率更高,因此建议考虑植入体表面特性对于产品安全性评价的影响,包括:
(1)在生物相容性评价中,建议申请人将植入体表面特性作为重要的考虑因素对所选取样品的代表性进行充分论证,尤其是植入、免疫毒性、生殖毒性、慢性毒性、致癌等项目。鉴于BIA-ALCL发病机理尚不明确,虽然不一定对不同表面的产品分别试验,但建议申请人按照GB/T 16886原则分别予以评价;
(2)在临床评价中,建议对不同表面特性的植入体分别进行;
4.建议申请人关注BIA-ALCL相关不良事件和投诉信息;
5.建议申请人在产品上市后仍持续加强远期的临床随访,收集BIA-ALCL数据,并随时进行风险-受益评价。

来源:AnyTesting


