您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2025-09-20 20:48
在药品的研发、放大、商业化生产中,我们都应当建立生产工艺过程的控制策略,以确保生产过程一直处于受控状态。有效的监控体系应能够保证持续的工艺能力和控制来满足产品质量,同时通过数据的获取与收集确定工艺过程持续改进的机会。在这当中,关键工艺参数(CPP)的控制直接影响产品的质量。那何为关键工艺参数?如何确认关键工艺参数?在产品生命周期内,关键工艺参数是否一直不变?产品质量如何控制?本文主要针对这些问题逐一展开,探讨关键工艺参数的底层逻辑。
一、何为关键工艺参数?
关键工艺参数最初出现在FDA倡导的质量源于设计(QbD)的理念中,并且在2015年发布了公开的专业报告Quality by Design for ANDA: An Example for Immediate-Release Dosage Forms(《质量源于设计案例研究:ANDA薄膜包衣片即时释放制剂》)中详细地阐述了产品目标质量概况(QTPP)、关键质量属性(CQAs)、关键物料属性(CMA)与关键工艺参数(CPP)之间的关系。
在ICHQ8(R2)中,也举例说明了产品目标质量概况(QTPP)、关键质量属性(CQAs)与关键工艺参数(CPP)等的识别关系。并对关键工艺参数(CPP)进行了定义:其波动会对关键质量属性(CQAs)产生影响的工艺参数。因此,需要被监测和控制,以确保工艺能生产出预期质量的产品。
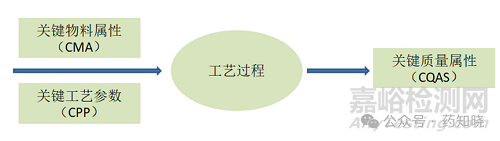
从FDA的专业报告及ICH Q8(R2)中总结一下上述几种概念的关系:关键质量属性(CQAs)属于产品目标质量概况(QTPP)的一部分,关键质量属性(CQAs)由关键物料属性(CMA)与关键工艺参数(CPP)共同决定。
药品生产依附于物料、生产工艺和生产设备,因此合适的物料属性、合理的生产工艺参数和工艺流程设计、良好的生产设备是保证药品安全性、有效性和质量可控的基础条件。下图简单地展示出了3者之间的关系。
二、如何确认关键工艺参数?
明确了关键工艺参数(CPP)对于产品质量的重要影响后,下一步就是如何确定关键工艺参数(CPP)!
一般来讲,确定制剂的关键工艺参数(CPP)分为3个阶段:(1)在建立控制策略之初,要对产品的质量及工艺有科学的理解,根据产品的关键质量属性(CQAs)初步确定可能的关键工艺参数(CPP),这一阶段属于理论推测;(2)实验室开发阶段,通过科学的试验设计,确定影响工艺性能和产品质量的可变工艺因素,并将这些工艺参数控制在可接受的范围内,并确定哪些工艺参数影响了产品的关键质量属性(CQAs),这一阶段属于关键工艺参数的初步筛选;(3)放大阶段,根据放大设备的性能,将初筛的工艺参数进行确认并控制在可接受的范围,得到最终的关键工艺参数。
(1)关键工艺参数的理论推导
制定QTPP:产品开发初期,从药品安全性、有效性两个维度评估,研究人员根据目标产品(参比制剂、原研药品、过评产品等)的质量概况评估出产品的关键质量属性(CQAs)。以FDA在2015年发布的公开专业报告中的“仿制布洛芬片”为例,定义了其QTPP,如给药途径、剂型、规格、释药方式、性状、含量、有关物质、溶出度、片重差异、稳定性等。
确定CQAs:基于药品在不符合质量属性要求时对患者造成危害(安全性和有效性)的严重程度,确定目标药品关键质量属性(CQAs)。确定CQAs需要由经验丰富的研发人员评估,因为这一步直接关系着后续开发的方向和着重点。
需要注意的是,关键质量属性一般会包含标准但不等同于标准,如片剂的溶出曲线一般不会订入质量标准。
以仿制布洛芬片为例,以上述方式评估出来的CQAs主要为鉴别、含量、含量均匀度、溶出度、有关物质和微生物限度。其中,鉴别和微生物限度可通过质量管理体系得到有效控制,处方工艺研究一般不会考察这些指标。
|
药品质量属性 |
目标 |
是否为CQAs |
依据 |
|
鉴别 |
确定原料药为布洛芬 |
是* |
虽然对于安全性和有效性来说,鉴别项是关键指标,但这个关键质量属性可通过质量管理体系得到有效控制,并会在药品放行时进行监测。处方和工艺变量不会影响鉴别项。因此,该关键质量属性在处方和工艺开发研究中将不讨论。 |
|
含量 |
100%标示量 |
是 |
含量差异将影响安全性和有效性,工艺变量可影响药品的含量,因此,含量是关键质量属性。 |
|
含量均匀度 |
符合中国药典2015年版0941项含量均匀度要求 |
是 |
含量均匀度差异将影响安全性和有效性。处方和工艺变量都影响含量均匀度,因此该质量属性将在整个处方和工艺开发中进行评估。 |
|
溶出度 |
按照FDA公开的溶出度方法,拟定30min时限度为标示量的80% |
是 |
不符合溶出质量标准可影响生物利用度。处方和工艺变量都可能影响溶出曲线。该质量属性将在整个处方和工艺开发中进行研究。 |
|
有关物质 |
符合法定标准 |
是 |
有关物质水平会影响安全性。需基于药典、ICH和RLD(参比制剂)的特性来控制杂质的限度,以限制患者的暴露量。处方和工艺的变量可能会影响有关物质。因此,有关物质水平是关键的。 |
|
微生物限度 |
符合现行版《中国药典》的要求 |
是* |
不符合微生物限度将会影响患者的安全。然而可以通过良好的质量管理体系控制微生物的限度。因此,该关键质量属性在处方和工艺开发中不详细进行研究。 |
关键工艺参数的推导:这一步不仅需要经验丰富的制剂人员评估,更加需要有科学的评估手段。FDA在2015年发布的公开专业报告(以下简称报告)介绍了如何利用科学工具(如鱼骨图、失败模型及影响分析(FMEA))对整个制剂工艺(从原料到成品)进行风险评估,筛选出可能影响CQAs的“潜在关键工艺参数”。
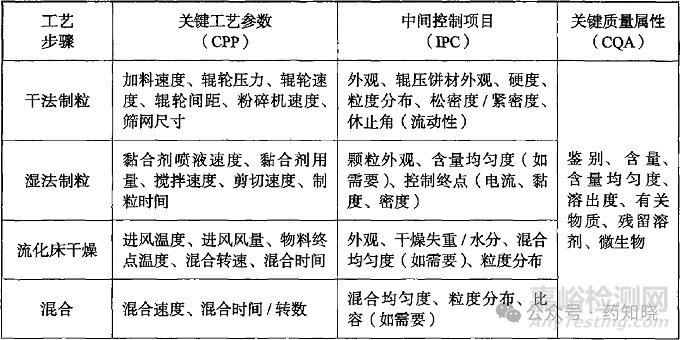
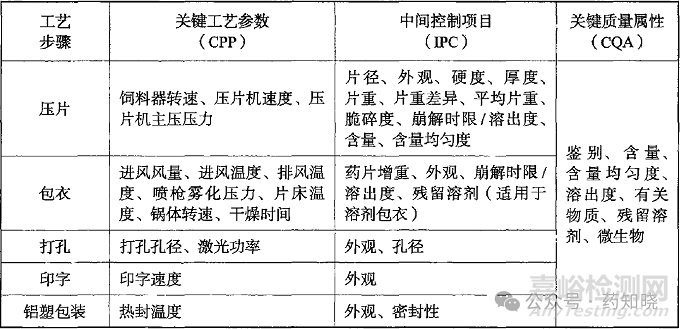
报告中详细介绍了如何进行风险分析,在开发初期,为避免遗漏某些关键工艺参数的研究,我们可以参考报告中的案例分析。此外,药品GMP指南中也介绍了固体制剂常见制备工艺中的关键工艺参数(见下图)。注意,产品审评过程中CDE让我们增加的关键工艺参数往往来源于其中。
(2)实验室阶段关键工艺参数的研究
这一阶段属于关键工艺参数的初步筛选,科学的试验设计会得到更科学的控制策略。只有那些通过实验证明对产品关键质量属性(CQAs)有显著影响,且必须严格控制以确保产品质量的参数,才能被定义为CPP。其他参数则为非关键工艺参数。报告中详细介绍了实验室阶段如何得到相对准确的关键工艺参数!
简单举例:以DoE和单因素试验研究湿法制粒中粘合剂用量、制粒时间对颗粒粒度分布(进而对含量均匀度和溶出度)的影响。单因素考察结果发现,粘合剂用量、制粒时间均会对产品的关键质量属性产生显著影响。而通过DoE试验设计,可能发现制粒时间是关键参数,而粘合剂用量在一定范围内不属于关键工艺参数。这种科学的手段会帮助我们深刻理解产品在后续放大生产中最大的风险点。当然,在实际研发工作中,我们为了进一步规避风险,往往会将经验认知内的关键工艺参数都从严控制。
报告中也列举了研究压片工艺中主压压力、压片速度对片剂硬度、溶出度的影响。结果显示,主压压力为CPP。研究包衣工艺中喷液速度、进气温度、锅速对包衣外观、溶出度的影响。结果显示,喷液速度和进气温度为CPPs。
(3)放大阶段关键工艺参数的确认
不同规模的设备,性能、参数范围差异较大,对产品质量的影响程度可能不同。因此在放大阶段,需要根据放大设备的性能,进一步确认关键工艺参数。
在放大阶段,每做一批投入都很大,我们经常会以当前工艺步骤输出的关键物料属性考察工艺参数的影响。这一点与实验室阶段不同,实验室阶段一般会直接以终产品的关键质量属性为评价指标。
举例说明:如在中试阶段确认关键工艺参数制粒时间对产品质量的影响,我们很少会连续做3批,分别设定制粒时间2min、3min、4min对产品溶出的影响。一般以1批物料分别在制粒2min、3min、4min时取湿颗粒,考察物料的制粒状态、粒度分布等关键物料属性,因为这些直接影响终产品的溶出。
需要注意的是,小试、放大设备性能的不同,会导致关键工艺参数范围差异较大。如对于一些有润滑剂的产品,小试阶段总混20min可能都不会产生过润滑现象,但因放大效应,总混10min即可能出现过渡润滑。因此,在放大阶段确认关键工艺参数,需要有丰富的放大经验。
三、产品生命周期内的关键工艺参数的变化
一般来讲,产品商业化批准前,放大批次的数量较少(3~6批),积累的关键工艺参数样本不多,存在一定的不确定性。商业化生产后,会持续输出关键工艺参数和产品质量的数据分析。此外,随着原辅料、设备的升级迭代,有些曾经的关键工艺参数不再适用,也可能产生新的关键工艺参数。因此,在产品的生命周期内,需要持续关注关键工艺参数的变更!
举例:某一片剂在首次申报时,采用烘箱干燥,关键工艺参数为干燥温度和干燥时长。上市后,干燥设备变更成流化床,因此关键工艺参数需要变更成进风温度、进风风量、物料终点温度。需要以补充申请的形式同时进行干燥设备、关键工艺参数的变更。
四、产品的整体控制策略
上述分析了如何制定关键工艺参数和参数范围,但产品的质量是由关键工艺参数(CPP)、关键物料属性(CMAs)、生产环境等共同决定,因此,我们需要建立整体的控制策略。
要理解,当前的关键工艺参数是基于目前的物料属性和生产环境,因此往往要对CMAs(如API的粒度、辅料的型号)设定控制标准,监控环境温湿度,规划持续工艺验证(CPV)方案,持续监控CPPs等控制策略。
以上是本文对于制剂关键工艺参数的一些总结和归纳,方便大家在开发工艺时有清晰的思路,用科学的分析手段制定合理的控制策略。

来源:药知晓


