您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2024-05-24 08:17
研究背景
药物的口服吸收通常受到患者胃肠道状况的影响,因为药物需要溶解在胃肠道液中,以促进药物吸收并确保药物治疗的有效性。最近,许多候选药物显示出较差的水溶性,因此,原料药的溶解度成了影响药物溶出和口服生物利用度的关键因素之一。特别是对于具有高渗透性和低溶解度的生物药剂学分类系统(BCS)II类化合物,药物吸收往往受到药物溶解度和溶出度的限制。
众所周知,95%的药物是酸性、碱性药物或这两种类型的组合。弱酸性药物在酸性pH下溶解度较低,在中性和碱性pH下溶解度较高。BCSII类药物在从胃转移到肠时会溶解并被吸收。因此,它们的口服吸收也会受到胃排空时间的影响。一般来说,进食后以及使用抗胆碱能药物、精神活性药物和对乙酰氨基酚后,胃排空时间会延长,弱酸性药物不能迅速溶解,导致药物的疗效低于预期;在胃pH值较低的健康人体受试者中,弱碱性药物预计会表现出低变异性的口服吸收,因为这些药物在酸性pH下的溶解度更高。然而,胃的pH值可能会根据患者的情况而升高。胃酸分泌不足通常发生在衰老、使用质子泵抑制剂或H2受体阻断药以及感染幽门螺杆菌或HIV时;胃酸的减少可导致胃肠道的pH值增加。在这种条件下,弱碱性药物可能无法在胃液中充分溶解,并可能表现出低的口服生物利用度和高变异性。因此,临床需求开发出在所有患者条件下具有一致治疗效果的药物产品。
可电离药物表现出pH依赖性溶解度,其中弱酸性药物在pH>pKa(电离常数)下更易溶,弱碱性药物在pH<pKa下更易溶。这种pH依赖性溶解度被广泛探索以配制难溶性药物增溶配方。弱酸性或碱性药物的成盐为具有pH依赖性溶解度的药物的配制提供了替代策略。在盐中药学上可接受的反离子在溶出于水时可以提供有利的pH条件,因此所得溶液的pH值将接近药物的最大pH值。盐的形成可以提高药物的结晶度、稳定性和制药加工性。盐型开发有的时候和难溶性药物pH调节技术具有异曲同工之妙。对于有些酸碱性化合物成盐并不是最优的选择,pH调节或许可以采用。
理论基础
药物从固体中的溶出已在许多先前的研究中进行了讨论和解释。通常,药物溶出速率(dCb/dt)和原料药饱和溶解度之间的关系使用Nernst-Noyes-Whitney方程进行解释:
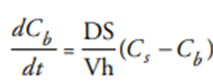
其中t是时间,D是扩散系数,S是溶解固体的表面积,V是溶出介质的体积,h是扩散层的厚度,Cs是药物在固体界面的饱和溶解度,Cb是药物在本体介质中的浓度。Nernst-Noyes-Whitney方程是在扩散层概念和Fick第二定律的基础上建立的。对于可电离药物,可以使用Henderson-Hasselbalch方程来考虑药物溶解度和pH之间的关系。一元酸性药物方程的表达式为:
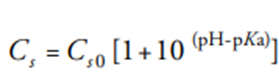
而对于一元碱性药物是:
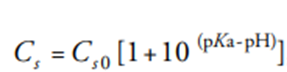
其中Cs是在给定pH下的药物溶解度,Cs0是固有溶解度。
根据Henderson-Hasselbalch方程,pH值的轻微变化强烈影响药物的水溶性。理论上,弱碱性药物的溶解度在其pKa和pH溶解度曲线中最大溶解度的pH之间的pH范围内随着pH的降低呈指数级增加。
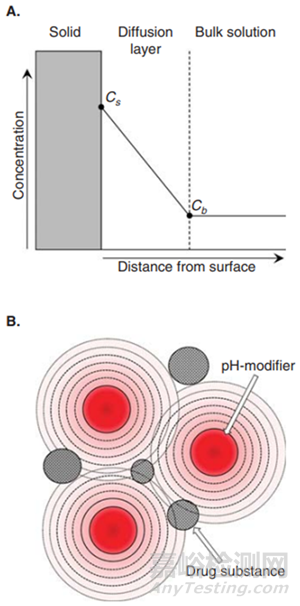
图1微环境pH调节方法。(A)药物从固体中溶出的扩散层模型。Cs,药物在固体界面的饱和溶解度;以及Cb,药物在介质中的浓度。(B)在微环境pH调节方法中为药物溶解创造有利的微环境pH的图像2
pH调节方法包括通过将酸性或碱性pH调节辅料溶解在制剂中来改变扩散区的微环境pH,以创造有利的微环境状态(图1B)。扩散层的pH调节可以显著增加Cs,导致药物溶解增加,然后在溶液中达到过饱和状态。在此,pH调节制剂可以是过饱和给药系统之一。由于可电离药物的溶解度可能因pH而变化,因此原料药周围微环境pH的微小差异将影响药物溶解的改善程度。因此,调节微环境区域的pH水平和维持适当pH的持续时间可能是改善药物溶解的关键因素。相反,微环境中显著较高的过饱和度可能导致游离药物的快速沉淀和/或重结晶。在这种情况下,基于聚合物的制剂,如固体分散体和骨架片,对于稳定过饱和状态和抑制再结晶是有效的。对于口服给药后实现更好暴露的pH调节方法来说,在溶液中过饱和状态的稳定可能是成功的。
实际应用
市面上有许多难溶性是采用pH调节技术配制而成的。环丙沙星是一种经典药物,呈弱碱性,在中性pH值下几乎不溶于水。然而,它在酸性条件下表现出pH依赖性的溶解度和更高的溶解度。大多数静脉注射制剂含有乳酸作为pH调节剂,以提高溶解度。静脉注射环丙沙星对于治疗不同种类的严重细菌感染至关重要。
替米沙坦是另一种表现出pH依赖性溶解度的药物。目前市面上销售的替米沙坦口服制剂含有碱性物质,如氢氧化钠和葡甲胺,用于pH调节。替米沙坦制剂以Micardis®品牌销售,采用昂贵的喷雾干燥工艺制造,其中药物和碱以及其他辅料溶解在水中并喷雾干燥以产生颗粒。据报道,获得的喷雾干燥颗粒具有与pH值无关的溶出曲线。然而,替米沙坦制剂的仿制药很难获得,因为该药物的游离酸形式不溶性,以及其制造过程中涉及的关键步骤,为创新者提供了额外的市值。
瑞格列奈是两性离子药物的一个例子,水溶性差,为37μg/mL。目前,瑞格列奈在美国以Prandin®
的名义销售,是以葡甲胺作为pH调节剂配制而成的。各种专利公开了在配方中使用葡甲胺和喷雾干燥作为制备颗粒的方法。在替米沙坦和瑞格列奈的情况下,制剂中不使用盐型的药物,而是将葡甲胺和氢氧化钠等碱添加到制剂中。这可能是由于技术原因,例如所得盐缺乏结晶度、稳定性差和潮解性。另一方面,在配方中加入碱可能是由于商业原因,为了在工艺和产品中建立复杂性,从而很难制作仿制产品。这些是如何通过改变配方策略在市场上推出具有临床和商业效益的药物产品的几个例子。
阿司匹林是具有百年历史的非甾体抗炎药(NSAID),但目前被多家公司探索以获得商业利益。目前市场上有阿司匹林的可溶性制剂。AsproClear是含有阿司匹林的可溶性泡腾片。通过在配方中加入碳酸氢钠和柠檬酸,可以促进阿司匹林溶解所需的泡腾和有利的pH条件。据报道,AsproClear比普通阿司匹林片剂更快地缓解疼痛。这是另一个例子,如何探索难溶性制剂技术以获得商业和临床效益。
案例分享
双嘧达莫是一种血栓素合成酶抑制剂,已在临床上用于预防术后血栓栓塞并发症或减少短暂性脑缺血发作的复发。它是弱碱性药物,pKa值为6.4,因此,其溶解度具有强烈的pH依赖性,在低于pH4的酸性范围内具有高溶解度,在pH 4以上溶解度呈现三个数量级的下降。因其低溶解性和高渗透性而被归类为生物药剂学分类系统(BCS)II类药物。一般来说,弱碱性药物有时表现出较差的口服生物利用度,变异性很大,这取决于患者的胃状况,尤其是低胃酸患者或通常使用质子泵抑制剂或H2阻滞剂的患者。
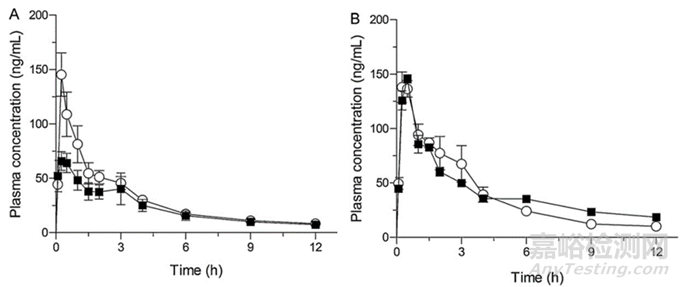
图4 正常和低胃酸大鼠口服双嘧达莫颗粒后的血浆双嘧达莫浓度:(A)DPG(口服,10 mg DP/kg)和(B)DPG/TS30(口服,10mg DP/kg)。(◯)正常大鼠;和(▅)低胃酸大鼠。数据代表4个实验的平均值±SE3
案例中开发具有酸性微环境pH调节剂的新型双嘧达莫(DP)制剂,以改善在低胃酸条件下的溶出和吸收。采用常规湿法制粒工艺制备了具有强酸性pH调节剂的双嘧达莫颗粒(DPG),在奥美拉唑处理的大鼠作为低胃酸模型。基于新DPG配方的可制造性、稳定性和溶出行为,发现对甲苯磺酸(TS)是DPG处方中合适的酸性pH调节剂。尽管DPG表现出依赖于pH的溶出行为,但具有TS的DPG在酸性和中性介质中都表现出较高的溶出速率和程度。奥美拉唑治疗的低胃酸大鼠口服DPG(10 mg DP/kg)后,与正常大鼠相比,DPG的血浆浓度随时间变化曲线下面积(AUC0-3)从0到3小时减少了约40%。然而,DPG/TS在低胃酸下的AUC0-3与正常大鼠的DPG几乎相同。从这些发现来看,在DP制剂中添加TS作为微环境pH调节剂可能有利于扩大DP在低胃酸患者中的治疗潜力。
总结
总之,口服药物吸收的速度和程度是由药物的物理化学性质、胃肠道生理因素和所给制剂的性质之间复杂的相互作用决定的。胃肠道pH值是影响口服药物吸收和生物利用度的重要因素,对药物的溶出度、溶解度、药物释放、药物稳定性和肠道通透性有重要影响。胃肠道的不同区域具有不同的药物吸收特性。因此,每个胃肠道区域的传递时间及其在受试者之间的可变性可能导致药物吸收速率和/或程度的可变性。如何针对药物理化性质,特别是酸碱性,并结合胃肠道pH梯度的变化,合理的设计处方,保证药物溶解性由pH依赖转变为非pH依赖,提高化合物溶解性的同时,降低药物在体内的可变性。
参考文献
1.Insoluble drug delivery strategies: review of recent advances and business prospects
2.Microenvironmental pH-modification to improve dissolution behavior and oral absorption for drugs with pH-dependent solubility
3.Novel formulations of dipyridamole with microenvironmental pH-modifiers for improved dissolution and bioavailability under hypochlorhydria

来源:药事纵横


