您当前的位置:检测资讯 > 监管召回
嘉峪检测网 2024-05-23 10:39
当地时间5月21日,英国药品和保健品监管局-MHRA发布政策意向声明,如果医疗器械在可比的监管机构 (comparable regulator country-CRC) 获得授权,则允许医疗器械自动进入英国市场,首先是澳大利亚、加拿大、欧盟和美国的监管机构。
早在今年早些时候,MHRA用新的药品国际认可程序(IRP)取代了其欧盟委员会决策依赖程序(ECDRP),允许该机构依赖选定的国际参考监管机构的决定,包括美国食品和药物管理局(FDA)、欧洲药品管理局(EMA)、加拿大卫生部、Swissmedic和日本药品和医疗器械管理局(PMDA)。
MHRA首席质量和准入官劳拉·斯奎尔(Laura Squire)将该计划描述为朝着制定医疗技术监管框架迈出的重要一步,该框架优先考虑患者准入和安全,并确保英国对医疗技术制造商保持吸引力。
“我们将继续致力于我们关于医疗器械国际认可的预期政策在实践中如何运作,”Squire在一份声明中说。“通过现在分享政策草案,我们的目标是更清楚地了解MHRA的未来方向,即在安全的情况下简化监管审批。
“与此同时,我们仍然完全致力于医疗器械的[英国合格评定(UKCA)]标志,”她补充道。“我们将继续扩大英国批准机构的能力,并努力确保UKCA标志支持安全和更早地获得最具创新性和变革性的医疗产品。
MHRA认为,拟议的医疗技术国际认可计划将减少CRC进行的重复监管工作,同时节省自身和制造商的资源。它补充说,制造商仍然可以使用UKCA Mark将产品推向市场。
根据MHRA计划,该拟议框架是一份草案,最终版本将与未来的核心法规同时生效,该法规的目标是在2025年生效。
该框架的操作方面涉及文件提交给谁、谁审查文件、谁执行随后的上市后监督和变更评估,以及这些评估的要求,这些评估的要求是在利益相关者讨论中根据可信顾问原则制定的,包括行业、指定批准机构和通过指定过程的申请人批准机构。
预计监管方法
拟议框架的可比监管机构(CRC)将是:
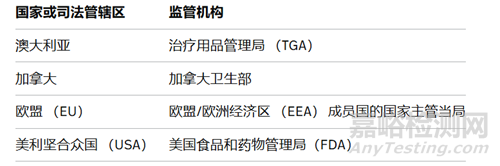
根据拟议准入途径,产品要符合拟议框架的要求,要获得拟议框架的资格,产品需要:
-符合可比监管国CRC的相关法规
-有英文标签和包装
-符合英国对电子产品兼容性(频率、电压和插头类型)、计量单位以及适用情况下对相关材料(例如,1A 或 1B 类致癌、致突变或对生殖系统有毒 (CMR) 的物质,或可能导致过敏或过敏反应的物质)的标签的要求。
-器械的所有方面(包括设计、制造工艺和预期用途)均应与目前在可比监管国CRC获准使用的器械一致
-有英国责任人,责任人的姓名和地址将包含在标签上
-按照《英国医疗器械法规》或可比监管国CRC的要求,在部件和标签上标注UDI
-遵守英国医疗器械法规中新的上市后监督 (PMS) 要求,该法规预计将于 2024 年生效
拟议的框架将提供国际认可证书,该证书将授予设备进入英国市场的机会,但不会提供UKCA标志或UKCA认证。
符合条件的器械的市场准入将符合可比监管国CRC提供的证书的有效性,并且必须在其原始证书(如适用)到期时重新认证。
在可比监管国CRC允许无限期市场准入的情况下(例如在美国),国际认可证书的有效期将符合质量管理体系(例如MDSAP证书)。
但以下这些器械不允许走国际认可路径:
-豁免的in-house器械
(in-house定义见https://www.gov.uk/government/publications/in-house-manufacture-of-medical-devices/in-house-manufacture-of-medical-devices或MDCG 2023-1的解释)
-定制器械
-软件作为医疗器械(SaMD)(包括人工智能作为医疗器械(AIaMD))产品不符合MHRA的预期用途指南
-通过依赖于与原产品等同的途径(美国 510(k))获得批准的 SaMD(包括 AIaMD)产品
-products granted market access in the CRC via a recognition route/通过认可途径获得 CRC 市场准入的产品
-通过与原产品等同的途径(美国 510(k))获得批准的 IIb 类(非WET)植入和 III 类医疗器械
-通过依赖于与原产品等同的途径获得批准的辅助诊断产品(美国 510(k))
-含有未在英国获得许可的药用物质的辅助诊断和组合产品
-不属于<UK MDR 2002>范围的产品
在MHRA进行认可自助注册器械
以下符合可比监管机构CRC要求分类的器械可自助注册/self-registration :
-I 类医疗器械,Is/m/r 类(Is:无菌;Im:测量;Ir:可重复使用)除外
-非无菌的 Class A IVD器械
这些器械需要由制造商申报适当的质量管理体系,如 ISO 13485 或特定产品的等同体系。
获得欧盟MDR/IVDR认证器械MHRA信赖措施
凡是符合欧盟MDR法规的Is/Im/Ir/IIa/IIb/III类器械,符合IVDR法规的CLASS A灭菌/CLASS B/C/D类器械 ,制造商需要以IMDRF 的 "‘table of contents’ "格式或 CRC 使用的等同格式提交档案。
在提交过程中不会审查完整的档案材料,但必要时可在审查上市后事件时对其进行评估,如将审查批准的证据、PMS 计划和相关的 PMS 报告或定期安全性更新报告 (PSUR)(如有)。
对于 AIaMD 或 CRC 中的分类与英国医疗器械法规中的分类不同的器械,会有不同监管措施,下文会进行介绍。
获得澳大利亚或美国上市前批准器械,英国MHRA要求
以下分类不包括 AIaMD 和 CRC 分类与英国医疗器械法规不同的器械:
I/m/Ir类医疗器械和IIa/IIb/III类器械,制造商需要以 IMDRF "table of contents "格式或 CRC 使用的同等格式提交档案。在提交过程中不会审查完整的档案,但在审查上市后事件时可能会根据需要进行评估,如将审查批准证据、PMS 计划和相关的 PMS 报告或 PSUR(如有)。
制造商需要提供植入器械在英国的植入卡和患者信息单。对于 III 类和植入器械,还需要提供安全性和临床表现摘要。
依赖简略评估和特定器械要求
主要适用于以下器械:
-符合加拿大器械法规或美国 DeNovo 或上市前通知 (510k) 法规的 Is/m/r 级医疗器械
-符合加拿大器械法规或美国 DeNovo 法规的 IIa、IIb、III 级医疗器械
-符合美国 510k 法规的 IIa 、IIb (非植入)和 IIb 级(WET)医疗器械
-符合澳大利亚、加拿大器械法规或美国上市前批准、DeNovo 或 510k 法规的CLASS A灭菌 IVD器械
-符合澳大利亚、加拿大器械法规或美国上市前批准、DeNovo 或 510k 法规的 B、C 和 D 级 IVD器械
-符合澳大利亚、加拿大、欧盟器械法规或美国上市前批准或 DeNovo 法规的 AIaMD
-在 CRC 中的分类与英国医疗器械法规中的分类不同的任何器械
制造商需要以 IMDRF "table of contents "格式或 CRC 使用的同等格式提交档案。在提交过程中不会审查完整的档案,但在审查上市后事件时可能会根据需要进行评估。
将审查批准证据、PMS plan和相关的 PMS report或 PSUR(如有)。
将对器械分类进行审查,因为该途径所采集的器械在 CRC 中的分类不同于英国医疗器械法规中的分类,制造商需要提供植入器械的植入卡和患者信息单。
对于 III 类和植入器械,以及CLASS C和D类 IVD,还需要提供安全性和临床表现摘要。
临床数据可能会在抽样基础上进行审查,而对于 AIaMD,则需要审查上市前(培训和测试)数据、实施验证和确认以及预定变更控制计划的使用情况。

来源:北京倍力医疗技术服务有


