2023年10月20日,CDE老师对ICH M7进行了线上专题培训讲解,本文针对培训中的问答进行了精选,以飨读者。
问题2 、晚期肿瘤适应症产品是否需要对致突变杂质进行控制 ?
讨论:
ICHI M7不适用的情形,不能简单认为不需要控制、不监管。应区分不适用的具体原因。
( 1〉 机理原因:非致突变途径致癌物质 (Ames实验与致癌性无关)、生物制品 ( 对 A m e s 实 验 等 有 干扰 ) , 宜 根 据 毒 理 学 数 据 , 合 理 讨 论确 定 控 制 限 度 。
问答文件: 在细菌回复突变试验中呈阴性的致癌物不通过DNA反应性杌制致癌。( 如乙酰胺和羟胶 ),因此不适用ICHM 7指导原则。
( 2 ) 患 者 原 因 : 晚期肿瘤患者, 急需治疗手段/急需获益 , 根据风险 / 获益 , 适当放宽要 求。
( 3 )监管原因:己上市药品、已上市铺料、矫味剂、着色剂和香料 、包材浸出 物等,为避免对行业早成过大冲击,暂末纳入指导原则。
己上市产品注意事项:
M7设计初衷是不适用于回顾性分析。但是一些上市后变更需重新评佔致突变杂质 相关的安全性:
• 原料药CMC部分的上市后交更(工艺条件改变)
• 制 剂 C M C 部分的上市后变更 (新 降 解 杂 质 )
• 己上市药品的临床用途变更 (剂量增加、服药时间延长、增加适应症 )
已上市药品总的原则是:
评估变更的部分;
采用与已上市原料药相同的合成路线无需评估;
关注序列、发现1类、2类杂质必须立即评估(包括原有杂质知晓危害性后) ;
除非杂质有“关注队列” (第了节,中的结构,否则仅凭杂质存在警示结构不足以 启动后续措施;
• 有确切的危害性数据 (研究符合指导原则要求 、 有 数 据 / 报 告 ) 。
问题3:本品尚处于临床试验阶段,是否可不对* * 致突变杂质进一步研究?
原则:临床试验阶段对遗传毒性杂质有要求,但同时认可本阶段信息有限 (杂质研究可能不充分 )
问题4:使用含一定致突变杂质 (如加标)的原料药,进行致突变试验,结果是阴性,是否可证明该杂质限度的合理性?
原则:
不能证明致突变杂质限度合理。M7针对的均是己鉴定杂质。
• FDA指导原则对此问题有明确解释:
It should be noted, however, that allowing genotoxicity assessment of the impurity as it is present with the drug substance, rather than in isolation, renders the genotoxicity assessments much less sensitive. For example, the potent mutagens that are typically used as positive controls in the bacterial mutation assay, such as 9-aminoanthracene and methyl methanesulfonate, when present with a noncytotoxic drug substance at the minimal level for qualification, would not be detected by these genotoxicity assays because the maximum concentration ofthe impurity at the limit concentration of the drug substance would not be sufficient to produce a genotoxic response in the assays.
但是上述结论也不是绝对的,如杂质含量较高,也可提供部分证据。
问题5:软件预测结果为超出范围(out of domain)如何处理? • 注意:out of domain 不等于5类 (无风险)。
问答文件:从两个(Q) SAR模型之一获取了超出应用范围或非覆盖范围的 结果时,还需要进行额外的评估才能将该化合物归为第5类杂质。
专家评价包括:
与具有细菌回复突变试验数据、且结构相似的类似物进行比较(交叉参照法)
由专家对化学结构进行评价以确定该化合物是否具有DNA反应性
采用相同方法 (如基于专家规则或统计规则 ) 的其他经验证的 ( Q ) S A R 模型输出结果,该结果应在其应用范围内。
问题6 : A me s 试 验阳 性 , 如何设定杂质限度 ?
问答文件:如果一个适当的体内试验的结果可以用 于补充证据权重法的己有数据,来支持一个更高的限度,
但此类情况时应遵 循具体问题具体分析的原则 。 然而 ,仅体内基因突变 试 验 目 前 还 不 能 直 接 评估癌症风险 ,因为其终点是致突变而不是致癌性(即它们被用于危害识别)。
问题7:间歇给药应如何计算?
每日可接受摄入量应根据给药总天数计算,而不是服药开始至停药的总时间 跨 度 。 例 如 , 2 年 期 问 每 周 服 用 一 次 的 药 物 (即 给 药 1 0 4 天 ) , 其可接受摄入量为每日20ug。
问题8:是否可以对可接受摄入量(A1)或每日允许暴露量(PDE) 采 用 短 于终 生 ( L T L ) 的可接受摄入量 ?
现 M 7 对采用T T C 拟定限度的化合物可根据给药时长(LTL ) 适当放宽。
问答文件 :
LTL方法 可 以 应 用 于基 于T T C 或特定化合物 / 类 别 A I 设 置 暴 露 限 度 的化合物。然而,此方法并不适用于PDE,原因是尚末有充分证据 表明,对 于國值相关的毒理学反应,采用给药时长线性外推的方法 是合适的。对于短期暴露 (30天或更短),更高的暴露水平也可能 被接受,但应 当具体问题具体分析。
问题9:什么时候适合采用方法4 ?
问答文件:证明在最终原料药中存的风险忽略不计。
(1) 基于科学原理 (如杂质反应性或溶解度)进行清除计算和预测杂 质水平低于TTC或AI的1%。
(2)根据清除计算结果预测的杂质水平大于等于TI C或AI的1%时 ,提 供实测得清除因子 (即掺杂和清除数据),表明杂质水平低于TTC或AI的 10%
注意:
( 1)基于工艺:考虑与工艺相关的条件,考虑反应性、溶解度、挥发 性 和 其 他 因 素, 采用保守的数值与方法 。
( 2 )由监管机构按照具体问题具体分析的原则做出评估, 包括要求提 供 额 外 的 支持性数据 。
( 3 )最后一步引入的杂质,仅提供预测性清除计算结果不够。
问题10 : 原料药中的检测数据在多个批次中始 终 < T T C 的 3 0 % 或 A I 的30% ,是否就足以支持在控制策略中无需对该杂质进行检测?
问答文件:
否,仅凭批次数据证明潜在的致突变东质始终< TTC的30%或AI的30% 不足以支持采用方法4控制 策略。
案 例 : 某NDA申报 , 经评估API中含某致突变杂质, 按 TTC 计 算 限 度 100ppm,建立了分析方法,实测工艺验证3批均<30ppm,拟不定入质量标 审评建议:对该致突变杂质建立合理的控制策咯。
具体处理方法 ( 1)订入质量标准。 (2)参考ICH Q6A建立定期确认性 检验策略。
审评案例:
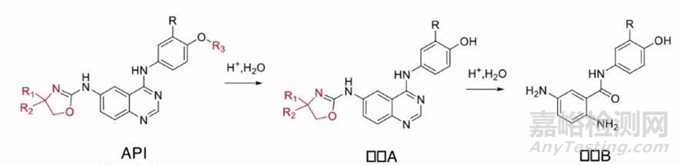
某公司开发 了如 下小分子化合物,申请进行临床试验,制剂开发为常规胶 囊剂,口服给药,规格** mg。拟开展剂量爬坡和剂量扩展的1期临床研究,探索其在人体内的安全性、耐受性、药代动力学特征、初步抗肿瘤疗效。
临床前动物安全性试验:细菌回复突变试验、中国仓鼠肺成纤维细胞染色体畸变试验、大鼠经又灌胃给药骨髓微核试验均为阴性。目前临床前安全性试验中并未观察到杂质B,也未针对杂质B进行研究 。
溶解度、强制降解试验、溶出研究发现API酸性 条件下不稳定。在0.1N HCI中溶液性质改变,溶液变 粘稠。0. 1M盐酸60°C加热10min发生降解,降解杂质约13%。制剂溶出研究发现杂质B为酸性条件下主要降解杂 质 。 p H 1. 0 、 p H 2 . 0 降解较显著 。
经沟通,申请人拟修订临床试验方案 (餐后给药)
审评认为:现有数据提示本品在人体胃酸条件下可能降解产生大量杂质B,该杂质为含有苯胶类警示结构的潜在遗传毒性杂质,临床前安全性试验中并未观察到该杂质,现开展临床试验具有一定的安全性隐患。