1.法规动态
医疗器械最常使用的灭菌手段是湿热、干热、辐射和环氧乙烷灭菌。有些含有动物组织的器械可能适合于这些常用的灭菌方法(如羊肠线通常用辐射灭菌),而其他一些器械,如生物心脏瓣膜或组织敷料,则不适合采用传统的灭菌过程,而使用液体化学灭菌剂灭菌。YY 0970-2013《含动物源材料的一次性使用医疗器械的灭菌 液体灭菌剂灭菌的确认与常规控制》提出了使用液体化学灭菌剂对含动物源性材料的医疗器械进行灭菌的确认和常规控制。
2023年3月14日,YY 0970更新发布,标准名称修订为《医疗保健产品灭菌 一次性使用动物源性医疗器械的液体化学灭菌剂 医疗器械灭菌过程的特征、开发、确认和常规控制的要求》,除标准名称调整外,更改了标准范围、术语与定义,增加了“法规依据”、“灭菌剂特征”、“过程和设备特征”、“产品定义”、“过程定义”、“保持灭菌过程有效性”。
新标准补充完善了“附录B《应用指南》”(原为2013附录A《指南》),增加“YY/T 0567与ISO 13408两项标准各部分之间的一致性程度” (附录A)、“灭菌过程杀灭率的确定”(附录C)、“微生物杀灭效果过程定义及微生物性能鉴定流程图”(附录D)等技术内容。根据新标准的要求,要确保液体化学灭菌过程的微生物杀灭是可靠的和可再现的,从而可以有充足的理由预测,灭菌后的产品上存在活微生物的极率很低。
图1 微生物杀灭效果、过程定义和微生物性能鉴定的活动及其相互关系
2. 方法确认
1、灭菌剂杀灭效果研究
灭菌剂杀灭效果研究证明灭菌剂对一系列代表性微生物的杀灭作用,识别杀灭作用的过程变量及相互作用(时间、温度、浓度、pH值),根据不同产品特征识别灭菌剂的传送/分布与有效性的关系,最终确定最低杀灭活性的过程变量组合。
2、菌株筛选实验
菌株筛选实验识别对此灭菌过程具有高抵抗力的微生物,包括来自产品生物负载和生产环境中的微生物,也包括已知天然耐受液体化学灭菌剂的参考微生物。在微生物杀灭效果研究中分离自生物负载或生产环境的微生物抗力接近或超过参考微生物时,灭活曲线应以生物负载或环境分离菌和参考菌株进行构建。
3、产品生物负载试验
3.1.生物负载的测定和微生物鉴定
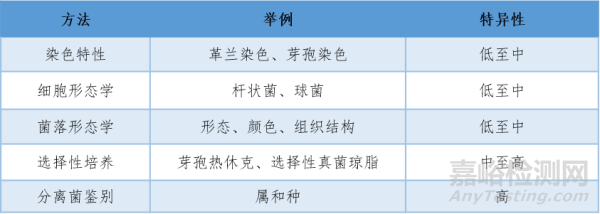
通过微生物的采集、微生物培养、微生物计数测定产品生物负载的数量。将获取的生物负载的微生物通过传统试验的分离菌鉴定通常提供微生物属于哪个科或属的指征(表1),更加复杂的生物化学、血清学及分子检测可确定分离菌的属或种水平。
表1 常用生物负载分类方法
3.2.生物负载方法的确认
生物负载方法的确认通常可以采用重复回收试验和产品接种法进行确认,前者的优势在于利用自然形成污染的微生物,但它经常需要一个相对较高的初始生物负载,后者可以用于自然污染水平较低的产品。
4、中和剂鉴定试验
在微生物杀灭试验中,用以消除试验微生物与消毒剂的混悬液中和微生物表面上残留的消毒剂,使其失去对微生物抑制和杀灭作用的试剂。通过中和剂鉴定试验结果,判断所选中和方法对液体灭菌剂是否有效中和。
5、灭活动力学
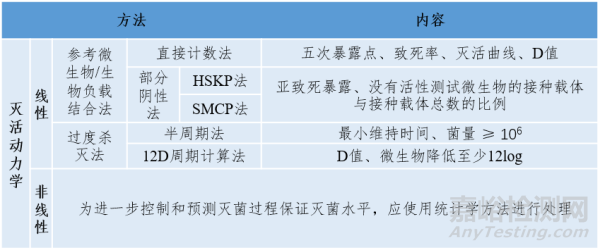
灭活动力学应由灭活曲线确定,灭活曲线由在微生物杀灭研究中识别具有高抗力微生物的存活数量的log10值对维持时间作图构建(表2)。
表2 灭菌过程杀灭率的确定
3.微生物能力
医疗器械研究检验中心具备专业的微生物测试团队,熟悉法规标准,熟练掌握微生物技术;现已建有无菌室、微生物限度室、微生物阳性室等,开展的测试项目包括但不限于无菌检查、微生物限度、控制菌检查、清洗消毒效果、微生物侵入、液体灭菌剂灭菌、抗抑菌效果评价、气/液体细菌截留、阻菌性测试等。
实验室可提供从方案确认、过程确认、效力验证等的一体化服务,可以在短时间、低样品使用量的情况下完成满足注册要求的高质量服务,可随时提供微生物检测全流程的技术咨询与培训。目前实验室可在4 ~ 6周内完成一个产品的液体化学灭菌剂项目。
参考标准
[1] WS/T 367:2012 医疗机构消毒技术规范
[2] YY 0970:2013 含动物源材料的一次性使用医疗器械的灭菌 液体灭菌剂灭菌的确认与常规控制
[3] GB/T 19973.1:2015 医疗器械的灭菌微生物学方法第1部分:产品上微生物总数的测定
[4] WS/T 798:2022 消毒剂消毒效果定性试验标准应用稀释法
[5] ISO 11137-1:2006 Sterilization of health care products-Radiation-Part 1: Requirements for development, validation and routine control of a sterilization-process for medical devices
[6] YY/T 0567.1:2013 医疗保健产品的无菌加工第1部分:通用要求
[7] ISO 11138-7 Sterilization of health care products- Biological indicators -Part 7: Guidance for the selection, use and interpretation of results