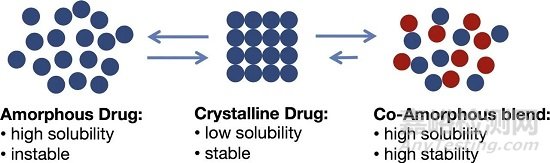
相对于晶型药物,无定型药物的分子长程无序、短程有序排列,表面自由能较大,因此在溶出过程中更容易分散,溶出速率更快。然而,这也使得无定型药物处于热力学不稳定状态。无定型药物存在热力学高能态,容易在制备、储存和给药过程中发生转晶,导致严重的稳定性问题。
为解决无定型药物的不稳定性缺点,同时借鉴药物共晶的单相二元体系,提出了另一种新的药物固态形式——共无定型。共无定型是一种由无定型药物和一种或多种低分子量组合形成的单相无定型多元体系,其DSC(差示扫描量热仪)图谱特征表现为单一玻璃态转变温度。
近年来,共无定型体系作为一种有望改善难溶性活性成分溶解度的技术被制药人员广泛深入研究。
共无定型体系优势
共无定型与固体分散体具有不同的理化性质。共无定型药物以小分子辅料或具有协同作用的药物活性成分为配体,而固体分散体以高分子聚合物为载体。为了维持高分散状态,固体分散体中聚合物的比例有时会达到8:1;制备固体分散体时,聚合物载体容易吸潮,可能导致转晶的发生。相比之下,共无定型药物一般选用小分子辅料或具有协同作用的药物作为配体,这使得制剂的质量控制相对于固体分散体更容易实现。
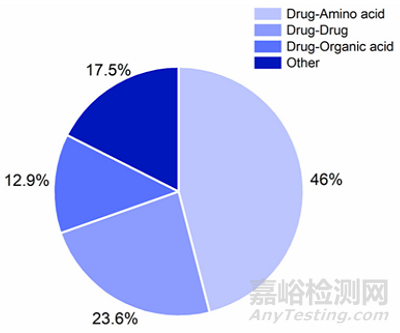
图:文献中报道的共无定型不同配体的百分比
成功开发共无定型药物的关键
药物配体的选择
选择合适的药物配体对于制备理想的共无定型药物尤为重要。不同组分之间的混溶性是形成稳定共无定型体系的重要因素之一。通过计算Hansen溶解度参数和Flory-Huggins相互作用参数,可以初步评估药物和所选配体的混溶性。目前,已报道的共无定型药物体系中,共无定型配体的选择主要分为以下几个类型:
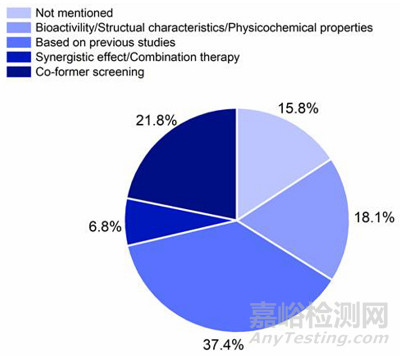
——基于之前的研究进行选择(37.4%)
——进行系统性的共无定型配体筛选(21.8%)
——考虑生物活性、药物和共成物的结构特征进行选择(18.1%)
——根据联合治疗的需求进行选择(6.8%)
图:共无定型配体选择的理由
适宜的制备工艺
选择适合的方法来制备共无定型药物是确保其质量的前提条件。制备方法可分为热力学方法和动力学方法。热力学方法包括溶剂挥发法、熔融-骤冷法、冷冻干燥法和喷雾干燥法等;动力学方法包括球磨法、研磨法、溶剂辅助研磨法和热熔挤出法等。不同的药物需要选择适合的制备方法。例如,卡维地洛在喷雾干燥后与酸性氨基酸谷氨酸和天冬氨酸形成稳定的无定型体系,但在球磨方法中无法形成共无定型。以下是各类共无定型制备方法的简要介绍。
溶剂挥发法:将药物和辅料溶解于适当的有机溶剂中,快速挥发溶剂以获得共无定型药物。药物和配体在溶剂中的溶解度、溶剂挥发时的温度和压力对共无定型药物体系的理化性质具有重要影响。该方法通常在较低的温度下进行,适用于制备热不稳定药物的共无定型药物体系。
熔融-骤冷法:首先将预先混合的原料药和配体加热至熔融状态,充分混合后。在低温环境下迅速冷却成固体。最后,在低温条件下进行干燥,得到共无定型药物。该方法的关键在于高温骤冷,使原料药分子没有时间重新排列,从而抑制药物晶核的生成,得到共无定型药物。该方法经济快速,适用于热稳定药物。
冷冻干燥法:冻干法先将样品预冻,然后在减压条件下将样品直接升华,最后除去剩余水分,适用于制备热敏性药物的共无定型体系。
喷雾干燥法:将各组分溶解于适当的溶剂中,通过特殊设计的装置进行喷雾干燥,在短时间内除去溶剂以获得干燥的产品,溶剂的快速挥发使药物分子来不及重新排列从而形成共无定型体系。该方法易于规模化和连续生产。
球磨法:球磨法是使用机械外力将药物和材料制备成共无定型物的技术。将药物置于球磨机中,通过高速撞击和摩擦等机械作用对样品进行充分挤压混合,破坏晶格从而获得共无定型药物。该方法对于热不稳定的药物存在一定风险,因此冷冻球磨是首选方法。
准确且详细的表征手段
为了更好地理解共无定型药物的理化性质,研究者使用多种技术对其进行表征。以下是共无定型药物的关键理化性质,通常分为热力学性质和动力学性质。其中热力学性质主要包括玻璃化转变温度 (Tg)、分子间相互作用力和结晶度等;动力学性质主要包括溶解度、过饱和溶出度、溶出速率和可混溶性等。
共无定型的相变及玻璃化转变温度检测:利用热分析(DSC)对不同摩尔比的共无定型二元物理混合物进行热分析,可以检测药物和共成物的熔融吸热和/或再结晶放热,并进行玻璃化转变温度的测定。
共无定型的结晶度检测:DSC被广泛用于测定无定型与晶体相变过程中的热力学性质, 而PXRD也是考察共无定型药物在加工和贮存过程中结晶度的成熟技术之一。此外,拉曼光谱技术也是一种测定无定型性质的灵敏方法,与结晶型相比,无定型的拉曼光谱通常表现为更宽的峰形,且有波数偏移。
共无定型研究案例
辛伐他汀-依折麦布共无定型
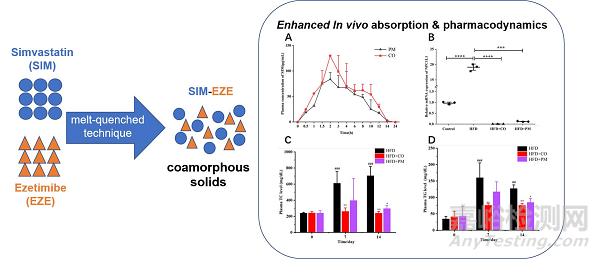
辛伐他汀通常与依折麦布联合应用于临床胆固醇降低治疗,但它们的溶解度和生物利用度较低。在这个案例中,辛伐他汀和依折麦布被制备成一个共无定型体系,以提高它们的溶解度、生物利用度和稳定性等方面的性能。研究人员采用熔融淬火技术成功制备了共无定型体系,并对形成的共无定型进行了表征。结果显示,共无定型体系相比物理混合物具有更好的物理稳定性和更快的溶解速率。
图:辛伐他汀-依折麦布共无定型示意图
在这个案例中,通过熔融淬火制备的共无定型样品,熔化的样品在液氮中迅速冷却,使得无序的药物分子无法重新排列结晶。同时,制备过程中不涉及溶剂,因此非常适用于热稳定性药物的共无定型制备。
未来展望
对于BCS Ⅱ类和Ⅳ类药物,它们在体内的吸收、分布、代谢过程中都存在一定的限制,导致它们的生物利用度较低。共无定型体系可提高难溶性药物的溶解度和溶出速率,具有提高药物生物利用度的潜力。此外,共无定型药物具有实现联合治疗的潜力,利用共无定型技术,可以将多种药物组合成一种无定型药物,从而实现联合治疗的效果,同时还能提高药物的溶解度和生物利用度。对于难溶性药物制剂的研发,共无定型技术具有广阔的应用前景。在未来的研究中,共无定型技术还可能与其他技术结合使用,进一步提高药物的溶解度和生物利用度,以及实现更加精准的治疗效果。
参考文献:
[1] Liu J, Grohganz H, Löbmann K, Rades T, Hempel NJ. Co-Amorphous Drug Formulations in Numbers: Recent Advances in Co-Amorphous Drug Formulations with Focus on Co-Formability, Molar Ratio, Preparation Methods, Physical Stability, In Vitro and In Vivo Performance, and New Formulation Strategies. Pharmaceutics. 2021 Mar 15;13(3):389. doi: 10.3390/pharmaceutics13030389. PMID: 33804159; PMCID: PMC7999207.
[2] Bahetibieke, S.; Moinuddin, S.M.; Baiyisaiti, A.; Liu, X.; Zhang, J.; Liu, G.; Shi, Q.; Peng, A.; Tao, J.; Di, C.; Cai, T.; Qi, R. Co-Amorphous Formation of Simvastatin-Ezetimibe: Enhanced Physical Stability, Bioavailability and Cholesterol-Lowering Effects in LDLr−/−Mice. Pharmaceutics 2022, 14, 1258. https://doi.org/10.3390/pharmaceutics14061258
[3] 方晓萍,胡义,卢山,曹艳.共无定形药物的研究进展[J].中国医药工业杂志,2022,53(07):953-961.DOI:10.16522/j.cnki.cjph.2022.07.004.
[4] Swapnil Jayant Dengale, Holger Grohganz, Thomas Rades, Korbinian Löbmann.Recent advances in co-amorphous drug formulations[J].Advanced drug delivery reviews, 2016. https://doi.org/10.1016/j.addr.2015.12.009.