在任何情况下,药品设计都应该符合患者的需求,达到预期的产品性能。药品研发的策略因公司而异,也因产品而异,药品研发的步骤和范围也各不相同,这些信息均应在申报资料中予以介绍。申报者可以根据历史经验,也可以采用更具系统性的方法(或者二者结合)进行药品研发。
采用QbD方法进行药品研发,目标是减少产品变异和缺陷,并通过研发可靠的产品和生产工艺,建立与临床表现相关的质量标准,并提高研发效率,减少产品批准后变更。其组成部分包括QTPP (确定目标药品质量概况),产品CQA(明确潜在的制剂的关键质量属性),产品开发和理解(确定原料药、辅料等的关键质量属性(CMA)), 工艺开发和理解(选择合适的生产工艺), 确定控制策略和持续改进等,最终产品和生产工艺得到评估,并在批准后的产品和工艺生命周期管理中得以不断改进。
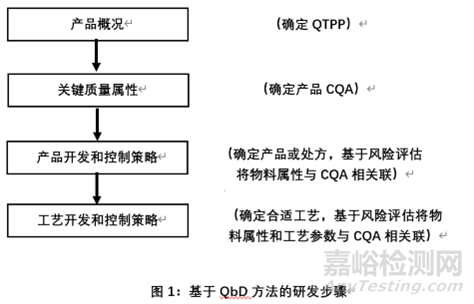
下图是基于QbD方法的研发步骤
下面将对研发步骤进行详细的阐述
1.确定目标产品质量概况
基于原料药属性和参比制剂特性以及参比制剂说明书与预期患者人群确定QTPP,目标产品质量概况是产品研发的设计基础。确定目标产品质量概况应考虑的因素包括:
预期的临床用途,给药途径,剂型,给药系统;
剂量规格;
容器密闭系统;
适合于所研发药品剂型的治疗活性成分的释放或传输, 以及影响药代动力学特性(如:溶出度,气动性能)的属性。
适合于拟定上市产品的药品质量标准(如:无菌性,纯度,稳定性和药物释放)。
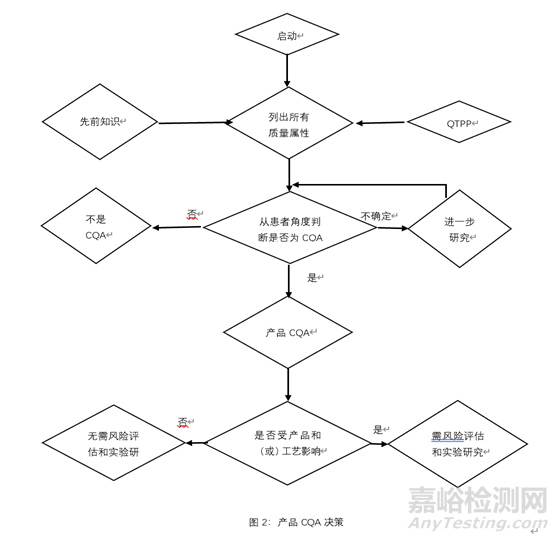
2.确定产品关键质量属性
关键质量属性(CQA)是应该在适当的限度、范围或分布之内的物理、化学、生物或微生物性质或特征,用以确保所需的产品质量和临床的有效性与安全性。一般来说,CQA 与原料药、辅料、中间体 (过程中物质)和药品相关。一个属性是否为CQA取决于当该属性超出可接受范围时由风险评估获得的该属性对临床有效性和安全性的影响程度和不确定性,下图是产品CQA决策树。
3.产品开发
3.1处方前研究
3.1.1参比制剂剖析
对参比制剂进行理化剖析确定参比制剂外观、规格、片重、片径、片厚、有无刻痕、有无包衣、硬度、崩解等物理特性及含量、有关物质、溶出度、溶出曲线等化学特性。
根据对参比制剂说明书、专利文献和对参比制剂的逆向分析,确定参比制剂处方及处方量。
3.1.2原辅料性质和风险评估
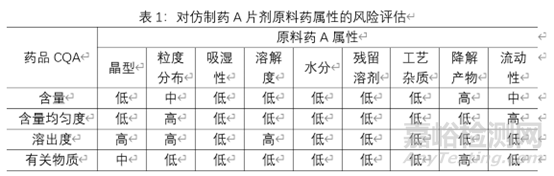
原料药:确定其物理性质(性状、晶型、熔点、溶解度、吸湿性、密度、流动性)、化学性质(pKa、化学稳定性)生物学特性(分配系数、细胞渗透率、BCS分类)。
对原料药属性进行风险评估:在研发阶段一般采用低、中、高风险分级系统评估相对风险。低:为可接受的风险,无需进一步研究;中、为风险可接受,可能需要进一步研究以降低风险;高:为风险不可接受,需要进一步研究以降低风险。通过风险评估,确定原料药的高风险属性,从而确定需要进行哪些研究,来增加对产品和工艺的理解,建立相应的控制策略。对物料属性的风险评估主要基于物料的理化和生物学特性等对产品CQA的影响。对产品CQA有明显影响的极为高风险属性。下表为仿制药A片剂原料药属性的风险评估实例,由于各制剂所用原辅料的特性,该风险评估额合理性说明不在阐述。
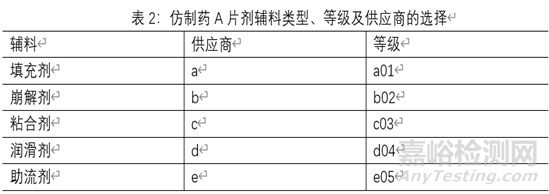
辅料:辅料是制剂的重要组成部分辅料的某些性质如粒度及粒径分布、密度、流动性、水分等会对某些关键质量属性产生明显影响。因此,对可能影响制剂CQA的辅料属性应进行详细分析和评估。在进行辅料风险评估前应根据参比制剂处方组成进行原辅料相容性试验,根据实验结果选择可以与原料药相容的辅料进行辅料属性评估。下表为某仿制药A片剂各辅料属性的风险评估实例:
一般制剂处方中,填充剂为乳糖和微晶纤维素,且二则者处方中占比较大,在片剂直压工艺中,其粒度及粒径分布、流动性有可能影响药品的含量均匀度,故应对二者的粒径分布、流动性进行重点进行评估。在处方中润滑剂一般为硬脂酸镁,但是硬脂酸镁具有疏水性,并能阻滞药物从固体制剂中溶出,在硬脂酸和片剂颗粒混合时,混合的变异系数增加,溶出速度降低,混合时间增加,片剂溶出速度和破碎强度降低,硬脂酸镁也可能增加片剂的脆碎度。故应对其等级进行重点评估。
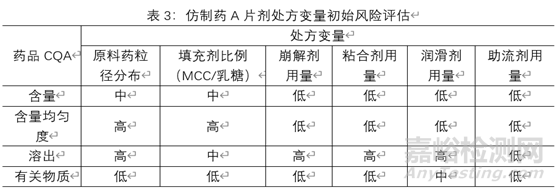
3.1.3处方变量初始风险评估:某仿制药A片剂示例见下表,由于各制剂特性及所用辅料的特性,该风险评估额合理性说明不在阐述。
3.2处方开发和理解
根据表:处方变量初始风险评估结果,对评为高风险的处方变量进行研究。
3.2.1考察不同原料药粒径分布对含量均匀度和溶出的影响
3.2.2考察填充剂比例(MCC/乳糖)对含量均匀度的影响
3.2.3考察崩解剂用量对溶出的影响
3.2.4考察粘合剂用量对溶出的影响
3.2.5考察润滑剂用量对溶出的影响
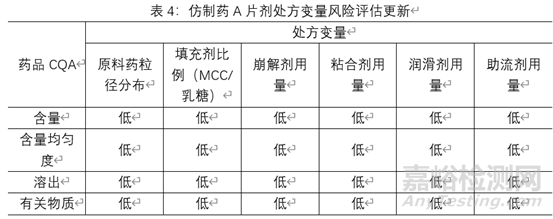
3.2.6处方变量风险评估更新
根据对各高风险处方变量的考察,确定了高风险处方变量的可接受范围,并将它们纳入控制策略之中下表总结了某仿制药A片剂处方变量风险评估更新,由于各制剂特性及所用辅料的特性,该风险评估额合理性说明不在阐述。
4.工艺开发
4.1根据对参比制剂说明书、专利文献和对参比制剂的逆向分析,确定参比制剂工艺及工艺步骤。对于普通片剂,选择合适的工艺:直压工艺、干法制粒、湿法制粒、流化制粒等。通过分析小试选择干法制粒工艺进行工艺研究。
下图列出了输入物料属性CMA和工艺参数CPP与产品关键质量属性CQA之间的关系:
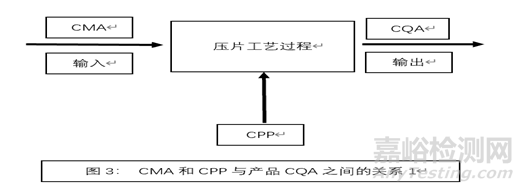
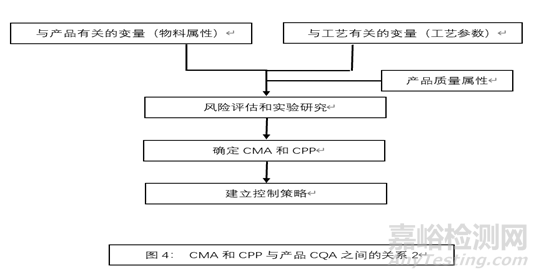
4.2工艺变量初始风险评估
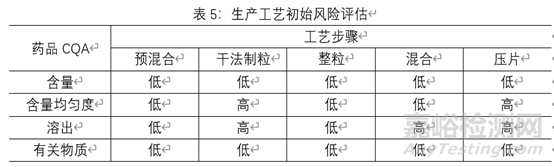
基于对临床有效性和安全性的考虑,确定可能被工艺步骤影响的产品CQA和确定影响产品CQA的每个工序工艺步骤中的输出物料(中间体)CQA,并对影响中间体CQA的物料属性和工艺参数进行风险评估,对评为高风险的物料属性和工艺参数进行研究,以便优化生产工艺并降低产品CQA不合格的风险。对整个生产工艺的风险评估结果见表5,由于各制剂特性及所用辅料的特性,该风险评估额合理性说明不在阐述。
4.3对评为高风险工艺步骤的工艺参数进行评估,将影响中间体CQA的物料属性和工艺参数评为高风险,对并这些高风险物料属性和工艺参数进行研究。
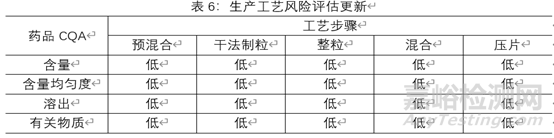
工艺变量风险评估更新
4.4根据对各高风险物料属性和工艺参数的考察,确定了高风险物料属性和工艺参数的可接受范围,并将它们纳入控制策略之中下表总结了某仿制药A片剂处生产工艺风险评估更新,由于各制剂特性及所用辅料的特性,该风险评估额合理性说明不在阐述。