您当前的位置:检测资讯 > 热点事件
嘉峪检测网 2023-01-20 10:20
今日头条
贝达CD73小分子抑制剂报IND。贝达药业自主研发并拥有完全自主知识产权的CD73小分子抑制剂BPI-472372片的临床试验申请获CDE受理,拟开发用于晚期实体瘤患者的治疗。BPI-472372能够特异性抑制CD73核苷酶的活性,下调肿瘤微环境中腺苷的水平,通过解除肿瘤免疫抑制从而发挥抗肿瘤作用。在临床前研究中,BPI-472372具有积极的体内外药效活性、良好的药代动力学及安全性。
国内药讯
1.BMS纳武利尤单抗在华获批新适应症。百时美施贵宝PD-1抑制剂欧狄沃(纳武利尤单抗注射液)获国家药监局批准新增适应症,联合含铂双药化疗用于新辅助治疗可切除的非小细胞肺癌成人患者。在国际临床(CheckMate -816)中,与化疗组相比,术前接受纳武利尤单抗联合化疗新辅助治疗的患者,在手术切除的原发灶和淋巴结标本中均未发现存活肿瘤细胞的患者比例更高(24%vs2.2%)。
2.基石RET抑制剂获批台湾上市。基石药业引进新药RET抑制剂普吉华(pralsetinib)获台湾监管部门批准,用于治疗局部晚期或转移的RET融合阳性非小细胞肺癌(NSCLC)、符合特定条件的RET突变甲状腺髓样癌(MTC)和RET融合阳性甲状腺癌患者。在国际Ⅰ/Ⅱ期ARROW临床中,pralsetinib在既往接受过铂类化疗的患者中达的到66.7%确认的客观缓解率(ORR),疾病控制率(DCR)为93.9%;在未接受过系统性治疗的患者中确认ORR为83.3%,DCR为86.7%。
3.君实新冠小分子口服药报产。君实生物旗下君拓生物与旺山旺水开发的口服核苷类抗新冠药物氢溴酸氘瑞米德韦片(JT001/VV116)的上市申请获CDE受理,用于新冠病毒感染的治疗。今年5月,VV116对比Paxlovid早期治疗轻中度新冠患者已达III期研究主要终点。数据显示,VV116非劣于Paxlovid(4天vs5天;风险比,1.17;95%置信区间,1.02~1.36),且不良事件发生率更少(67.4%vs77.3%)。
4.和誉CSF-1R抑制剂获批cGVHD临床。上海和誉生物小分子CSF-1R抑制剂Pimicotinib (ABSK021)获国家药监局临床默示许可,拟开展评估用于慢性移植物抗宿主病(cGVHD)的II期临床研究。Pimicotinib能够阻断CSF1/CSF-1R信号通路可调节和改变巨噬细胞功能,在多种巨噬细胞相关疾病中发挥作用。目前,该新药用于腱鞘巨细胞瘤(TGCT)的临床开发已进入III期临床阶段。
5.启愈SIRPα/PD-L1双抗国内获批临床。启愈生物1类生物制品“注射用Q-1801”获国家药监局临床默示许可,拟用于晚期实体瘤的治疗。Q-1801是全球首款进入临床开发的SIRPα/PD-L1双抗,已于去年9月获批在美国开展临床研究。Q-1801通过SIRPα抗体阻断SIRPα和CD47结合,活化巨噬细胞对肿瘤细胞的吞噬以及DC细胞的抗原呈递能力,并且通过PD-L1抗体阻断PD-L1抑制信号,激活T细胞对肿瘤的特异性杀伤效应。
6.宜明昂科CD47抑制剂获批临床。宜明昂科靶向CD47的SIRPαFc融合蛋白IMM01获国家药监局临床默示许可,拟联合硼替佐米和地塞米松开展治疗多发性骨髓瘤的Ib/Ⅱa期临床试验。IMM01可特异性激活巨噬细胞,使其将肿瘤细胞的抗原传递给下游的T细胞,从而起到显著的肿瘤免疫治疗效果。目前,IMM01已有多个适应症进入II期临床开发,涵盖血液肿瘤以及实体瘤。
7.杭州纽安津个体化多肽疫苗报IND。杭州纽安津生物基于人工智能技术开发的免疫治疗产品注射用P01的临床试验申请获CDE受理。这是一款非细胞类的个体化肿瘤治疗性疫苗产品,它通过皮下注射给药,能够激活新生抗原特异性的T细胞,从而达到训练免疫系统更有效识别并杀伤肿瘤细胞的目的。它激活的新生抗原特异性T细胞在杀伤肿瘤细胞的同时,不会对体内正常细胞造成伤害。
国际药讯
1.卫材Aβ抗体治疗AD在日本报产。卫材阿尔兹海默症药物Lecanemab已向日本监管机构递交上市申请。这是一款Aβ抗体,已获FDA加速批准上市,商品名Leqembi,美国市场的定价为2.65万美元/年。发表在《新英格兰医学杂志》的III期Clarity AD试验结果显示,lecanemab较安慰剂使患者临床痴呆评分总和(量化痴呆症状的各种严重程度,CDR-SB)下降减少27%,患者大脑中淀粉样蛋白水平显著下降59.1centiloids。
2.莫徳纳RSV疫苗用于老年人Ⅲ期临床成功。Moderna公司编码RSV融合前F糖蛋白的mRNA疫苗mRNA-1345,在用于60岁以上老年人预防呼吸道合胞病毒(RSV)相关下呼吸道疾病(RSV-LRTD)的关键Ⅲ期临床ConquerRSV获积极结果。与安慰剂组相比,mRNA-1345组出现两种或两种以上RSV-LRTD症状的病例数目更少(9例vs55例),疫苗预防效力达到83.7%(95.88% CI:66.1%,92.2%;p<0.0001),而且疫苗的总体耐受性良好。Moderna计划今年上半年递交监管申请。
3.创新sPLA2抑制剂皮炎Ⅱ期临床积极。Edesa Biotech公司sPLA2抑制剂EB01乳膏治疗过敏性接触性皮炎(ACD)的Ⅱb期临床结果积极。与安慰剂相比,1%浓度的EB01乳膏使患者28天后达到皮炎严重程度指数(CDSI)改善的比例更高(60%vs39%,p=0.02);研究者静态整体评估 (ISGA) 获得“清除”或“几乎清除”分数且从基线至少提高2分的患者比例也更高(53%vs29%,p=0.48)。预计该公司将在年中之前完成临床试验的数据分析。
4.创新口服CETP抑制剂降脂Ⅱ期临床积极。NewAmsterdam公司胆固醇酯转移蛋白(CETP)抑制剂obicetrapib与ezetimibe联用,在辅助治疗心血管疾病患者的Ⅱ期临床达到主要终点。Obicetrapib旨在通过阻断CETP的功能,在降低低密度脂蛋白胆固醇(LDL-C)的同时提高高密度脂蛋白胆固醇(HDL-C)的水平。试验结果显示,接受治疗84天后,组合疗法组的LDL-C水平降低59%,安慰剂组降低6%;而且组合疗法耐受性良好。
5.Leap公司囊获消化道癌症Claudin18.2抗体。Leap Therapeutics公司宣布收购Flame公司,并获得该公司临床早期Claudin18.2单抗FL-301,以及临床前抗体Claudin18.2/CD137双抗和GDF15单抗。Claudin18.2在包含胃癌在内的消化道癌症中高度表达,它有可能成为治疗胃癌、胰腺癌等实体肿瘤的有效靶标。目前,FL-301正在中国开展Ⅰ期临床试验。
医药热点
1.新版医保药品目录发布。国家医保局公布2022年国家医保目录调整结果,本次调整共有111个药品新增进入目录,3个药品被调出目录。147个目录外药品参与谈判和竞价(含原目录内药品续约谈判),121个药品谈判或竞价成功,总体成功率达82.3%。谈判和竞价新准入的药品价格平均降幅达60.1%。阿兹夫定片、清肺排毒颗粒等2个药品通过谈判降价将正式纳入国家医保药品目录。
2.重性精神疾病临床诊疗中心开工。国家精神疾病医学中心(上海市精神卫生中心)“重性精神疾病临床诊疗中心”项目开工,将重点完善疑难危重精神障碍诊疗体系,助力精神卫生事业发展新蓝图。诊疗中心总建筑面积73904 平方米,包括一幢重性精神疾病临床诊疗中心和一幢能源中心,集门诊、住院、康复、教育培训、临床研究以及相关配套功能为一体,极大改善医疗环境和患者体验,还将有力促进人才培养、学科建设和医院管理全面提升。
3.广东:种植牙单颗拟不超4500元。近日,广东省医保局官网发布《关于做好口腔种植医疗服务收费和耗材价格专项治理有关工作的通知(征求意见稿)》提出,将单颗常规种植牙全流程收费调整为政府指导价,最高价不超过4500元,其中,粤东粤西粤北12个地市最高价不超过4300元。
评审动态
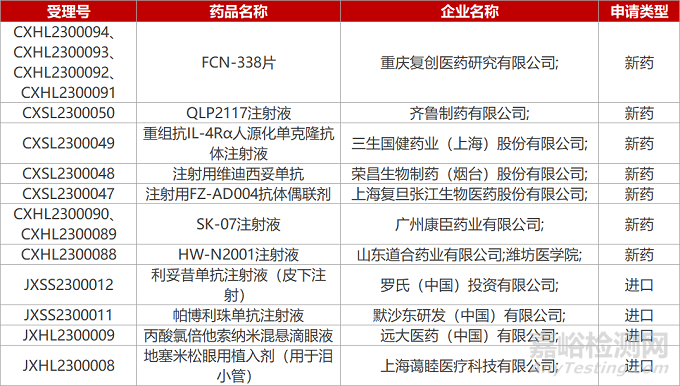
1. CDE新药受理情况(01月18日)
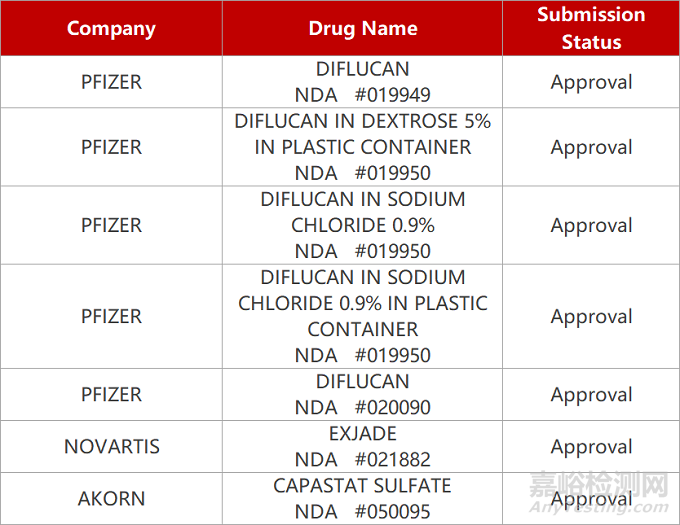
2. FDA新药获批情况(北美01月17日)
股市资讯
上个交易日 A 股医药板块 -0.43%
涨幅前三 跌幅前三
昂 利 康 +9.99% 迈威生物-5.05%
太极集团+5.27% 诺诚健华-4.58%
恩威医药+2.99% 首药控股-4.54%
【复旦张江】注射用 FZ-AD004 抗体偶联剂用于治疗晚期实体瘤获得药物I期临床试验申请受理通知书。
【迪瑞医疗】(1)近日取得由国家药监局颁发的2项《医疗器械变更注册(备案)文件》,包含糖类抗原19-9测定试剂盒(化学发光免疫分析法)、细胞角蛋白19片段测定试剂盒(化学发光免疫分析法)。(2)收到知识产权局颁发的1项《发明专利证书》(一种分离式液体泄压报警装置)。
【人福医药】(1)预计2022年实现归母净利润22-26亿元(+67.03% - 97.40%),扣非净利润13-17元(+29.27% - 69.04%)。(2)子公司宜昌人福注射用盐酸瑞芬太尼增加适应症申报生产获得受理。

来源:药研发


