您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2022-09-15 14:04
前言
药品研发阶段对关键质量属性(CQA)的认知一般来源于对药品工艺知识、药品安全性和有效性的理解。药品研发与生产过程中需确定药品生产工艺中的关键质量属性(CQA)、关键工艺参数(CPP),药品研发与生产过程中如何对关键质量属性(CQA)、关键工艺参数(CPP)进行评估,其评估的方法、过程是什么?本文从质量管理的角度,对评估的方法、过程谈一些自己浅到的见解。
一、什么是关键质量属性(CQA)、关键工艺参数(CPP)
1、关键质量属性(CQA):物理、化学、生物学或微生物学的性质或特征,应当有适当限度、范围或分布,以保证预期的产品质量。
2、关键工艺参数(CPP):此工艺参数的变化会影响关键质量属性,因此需要被监测及控制,确保生产产品的质量。
二、参考文件、评估目的
1、参考文件
1.1 ICH Q8 药品研发
1.2 ICH Q9 质量风险管理
2、目的:通过对xxx生产工艺中的关键质量属性和关键工艺参数进行评估,确定xxx生产工艺的关键质量属性和关键工艺参数,为生产工艺以及相关的质量管理提供基础信息,保证产品的生产质量。
三、谁去评估
关键质量属性(CQA)、关键工艺参数(CPP)的评估,一般情况下,应由下属人员组成:
药物研发人员
药物临床试验人员
质量风险管理人员
质量保证人员
质量控制人员
生产管理人员
生产操作人员
设备管理人员
四、CQA/CPP评估基本原则
1、CQA/CPP评估是基于ICH Q8《药品研发》中管理理念的理解和认识,基于质量管理人员的经验性做法所开发的评估方法。
2、 CQA/CPP评估依据相关资料进行,包括药品的前期研发、临床资料、生产工艺规程、岗位操作规程、小试或中试生产过程中积累的数据等。
3、 CQA/CPP涉及到不同专业知识和技能,CQA/CPP评估需成立风险评估小组。
4、关键物料属性(CMA)不统计在CQA/CPP结果中。
5、CQA/CPP评估应形成正式化的风险评估报告,并经相关部门负责人审核,质量负责人批准。
五、关键质量属性(CQA)评估
1、关键质量属性(CQA)的确定
关键质量属性的评估应基于对药学和医学的双重认知,评估过程中应有效应用药物研发和药物临床试验的数据。
一个属性是否为产品关键质量属性的因素,包括但不限于:
某一属性直接影响药品的安全性、有效性、均一性,该属性应
被认为是关键质量属性;
法律法规明确规定检测的质量属性;
即使某一属性与患者的安全性或产品的有效性之间尚未最终。
建立一种直接的科学的关系,但是基于对药学的普遍认识,其属性影响药品的质量。
某一质量属性测量的不确定性。
满足以上四项因素中任意一项,可判断其为关键质量属性。
2、关键质量属性评估
2.1 执行关键质量属性评估时,应首先评估最终产品(药品)的CQA,然后按照工艺流程的顺序,不断逆向推导评估上一个工序中间产品的关键质量属性,直至推导到原辅料为止。成品、中间产品、原辅料的属性符合关键质量属性的4个因素任意一项,成品、中间产品的评估结果被定义为关键质量属性(CQA),原辅料的评估结果将被定义为关键物料属性(CMA)。
2.2 逆向推导过程中,物料的属性可以跨越工序传递或影响,物料的属性的评估应采用所有工序联合的矩阵式评估方法,并不仅仅限制在相邻工序之间开展。
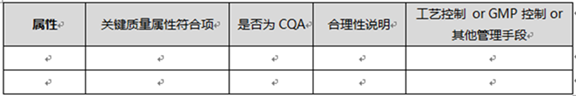
2.3 某项质量属性被确定为关键质量属性(CQA)时,应该出明确的评估理由,并给出后续的控制方案。
2.4 如果中间产品或最终产品的某项属性被列入关键质量属性范围,则该属性应明确列入生产工艺规程或质量标准中,执行严格的工艺控制管理或GMP控制。
2.5 如果中间产品或最终产品的某项属性未被列入关键质量属性范围,则该属性可不被列入生产工艺规程或质量标准中,并通过其他质量管理手段进行管理或控制。
2.6 关键质量属性评估过程、结果应形成列表,关键质量属性评估表如下:
关键质量属性评估表
六、关键工艺参数(CPP) 评估
1、潜在CPP评估
CPP评估过程中,主要参考产品研发及商业化生产工艺本身的知识,一般认为,关键工艺参数一定和关键质量属性之间存在影响关系。如果某项关键工艺参数超出控制范围,可能导致与此相关的关键质量属性超出质量标准。
2、潜在工艺参数评估参考标准
一个参数是否为潜在工艺参数的因素,包括但不限于:
工艺参数本身范围窄;
工艺参数控制能力弱,不易控制;
工艺参数测量的不准确性高。
满足以上三项因素中任意一项,可判断其为潜在关键工艺参数。
3、关键工艺参数评估
3.1 对于已经被判断为潜在关键工艺参数的参数群,应继续开展风险评估,然后根据风险评估结果,确定最终的关键工艺参数范围。
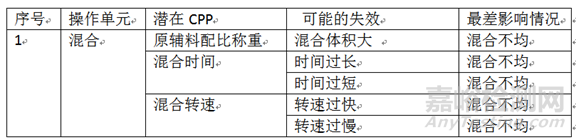
3.2 针对每个已经被判断为潜在关键工艺参数,从可能的失效、最差影响情况两个方面进行风险识别、分析,如下表:
风险识别、分析表
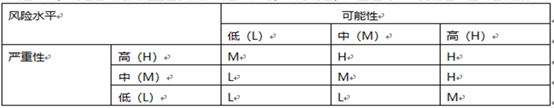
3.3 对每个潜在CPP识别出风险,需从可能性、严重性两个维度进行评估,从而确定其风险级别,风险级别判定标准如下:
风险级别判定标准
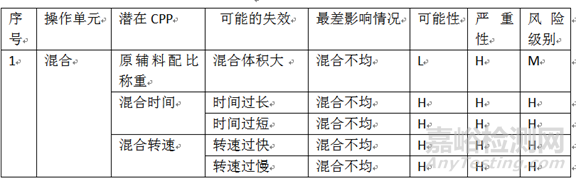
3.4 针对潜在关键工艺参数的风险评估结果,列出风险评估矩阵:
风险评估矩阵
3.5 风行评估结果判定
如某项潜在关键工艺参数在评估过程中认定存在中级(M)或高级(H)风险,则该参数应被认定为关键工艺参数(CPP)。
如果项潜在关键工艺参数在评估过程中认定存在低级风险(L),则该参数将转入重要工艺参数(KPP)的范围进行监管。
七、CQA/CPP 评估结果应用
1、 应针对各项CQA进行分析,考虑纳入质量标准进行管理的必要性。
2、 所有的CPP和KPP应当纳入生产工艺规程进行管理。

来源:药事纵横


