您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2022-08-14 21:32
可见异物系指存在于注射剂、眼用液体制剂和无菌原料药中,在规定条件下目视可以观察到的不溶性物质,其粒径或长度通常大于50 μm[1]。可见异物的监控是保证注射剂安全使用的一项重要指标,由于注射剂的给药途径为静脉注射或肌内注射,而人体微循环血管的直径只有7 ~ 12 μm,一旦可见异物或不溶性微粒被注射入人体,不仅影响药物的治疗效果,甚至会引发静脉炎、休克、血栓、过敏等症状,严重影响患者的生命安全[2]。
酮咯酸氨丁三醇(ketorolac tromethamine,1)为临床常用的非甾体类抗炎药,通常用于手术后镇痛。1 注射液自上市以来,一直存在含有颗粒物的问题,如英国Hospira 公司等曾在全球范围内召回多批次注射液,召回原因为注射液中含有颗粒物。可见异物可导致局部炎症、过敏反应、肉芽肿形成或微栓塞效应,具有一定的安全隐患[3—4]。目前,国内药物研发机构对可见异物成因及监控方法的认知水平均较低,本研究尝试采用先进的分析仪器对1 注射液中的可见微粒进行定性分析,以期为未来研发过程中可见微粒的成因及控制方法研究提供参考。
1、仪器与试药
YB- Ⅱ型澄明度检测仪( 天津市光学仪器厂) ;AvanceⅢ 400 MHz 型核磁共振谱仪和XFlash630 型能谱仪均购于德国Bruker 公司;SQD2 型液相色谱质谱联用仪( 美国Waters 公司) ;LAMBDA 365 型紫外- 可见分光光度计( 美国PerkinElmer 公司) ;Nicolet IS10 型傅里叶变换红外光谱(FT-IR) 仪( 美国Thermo Fisher Scientific 公司) ;Q45 型扫描电镜( 美国FEI 公司) ;1 注射液[ 山东新时代药业有限公司, 批号180401( 用于收集可见微粒,所得可见微粒为受试样品)、F1903021-1] ;1 注射液( 厂家A,批号93090DK) ;氘代二甲基亚砜(DMSO-d6,美国CIL 公司,纯度99.9%,批号PR30847/04309DM1) ;甲醇为色谱纯;玻璃安瓿( 山东力诺玻璃制品有限公司,批号19010209-02、19010209-01、18120212) ;聚丙烯(PP) 安瓿( 山东华鲁制药有限公司,批号F1903021、F1903031、F1903041)。健康雄性日本大耳兔12 只,体质量2 160 ~ 2 564 g,年龄104 ~ 134 d,购于邳州市东方养殖有限公司,动物合格证号201920159,本试验涉及的动物试验的相关内容和程序均由国家伦理委员会批准。
2、方法与结果
2.1 可见微粒的分析表征
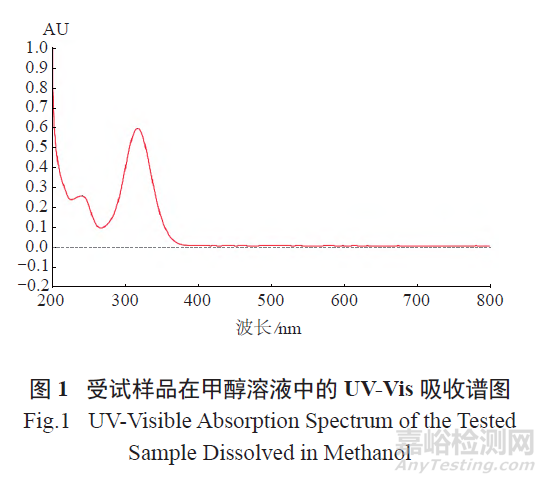
取1 注射液( 批号180401),置2 ~ 8 ℃环境中贮存,放置12 个月后,汇总注射液,过滤,收集滤出物,即为可见微粒,作为受试样品,干燥后进行下述表征分析。2.1.1 紫外- 可见吸收光谱(UV-Vis) 分析将受试样品溶解于甲醇中,配制成质量浓度约为9.7 μg/ml 的溶液,进行UV-Vis 吸收光谱扫描( 扫描范围200 ~ 800 nm)。其UV-Vis 吸收谱图见图1,受试样品的甲醇溶液在241 nm 处有弱的吸收峰,为酮基取代苯产生的E2 带红移;在317 nm 处有强的吸收峰,为共轭结构π-π* 跃迁吸收,峰位稳定,说明样品分子结构中含有苯环和共轭结构。
2.1.2 FT-IR 分析
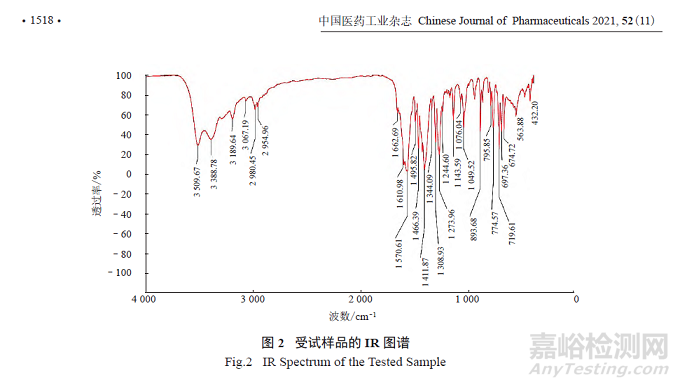
采用溴化钾压片法将受试样品进行压片后,进行FT-IR 分析,设置分辨率为4.0 cm–1,扫描次数为16。结果如图2 所示,样品分子结构中含有痕量水、游离酸、芳环、亚甲基、酮基、羧酸盐和碳氮键结构,具体数据分析见表1。
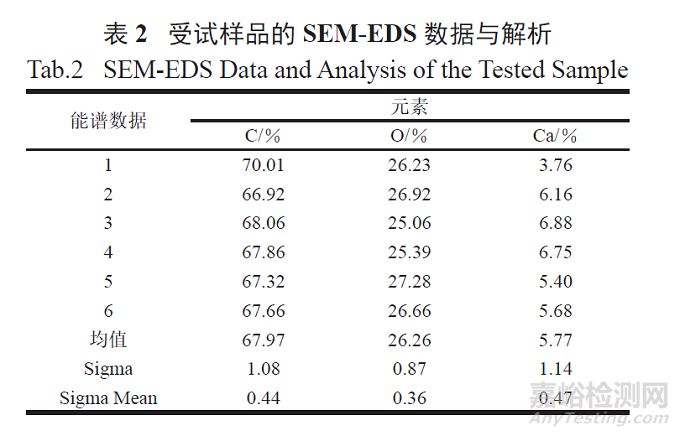
2.1.3 扫描电子显微镜- 能谱(SEM-EDS) 分析
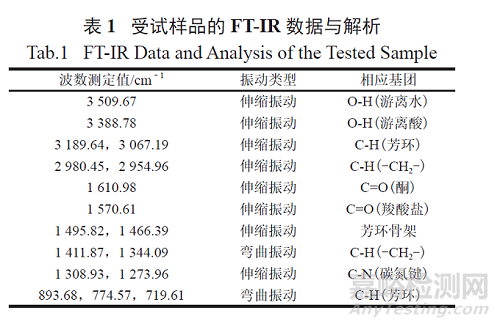
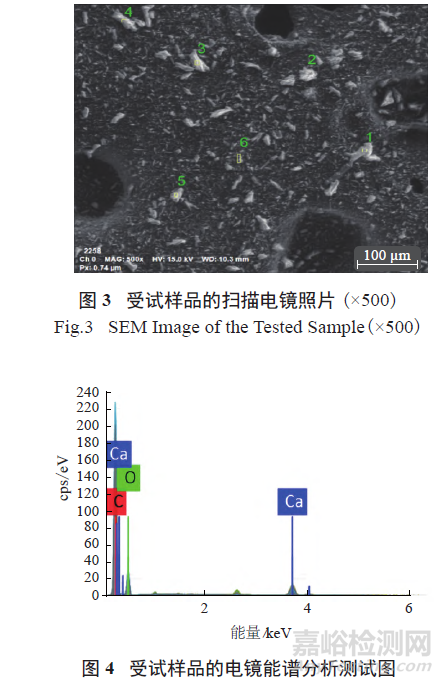
按照GB/T 17359-2012 微束分析能谱法对受试样品进行定量分析,设置参数High voltage 为15.0 keV。受试样品的电镜能谱分析测试图见图3 ~ 4,数据分析见表2。结果表明,样品中含有钙元素。
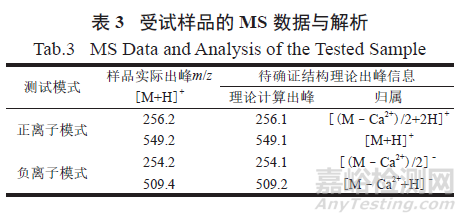
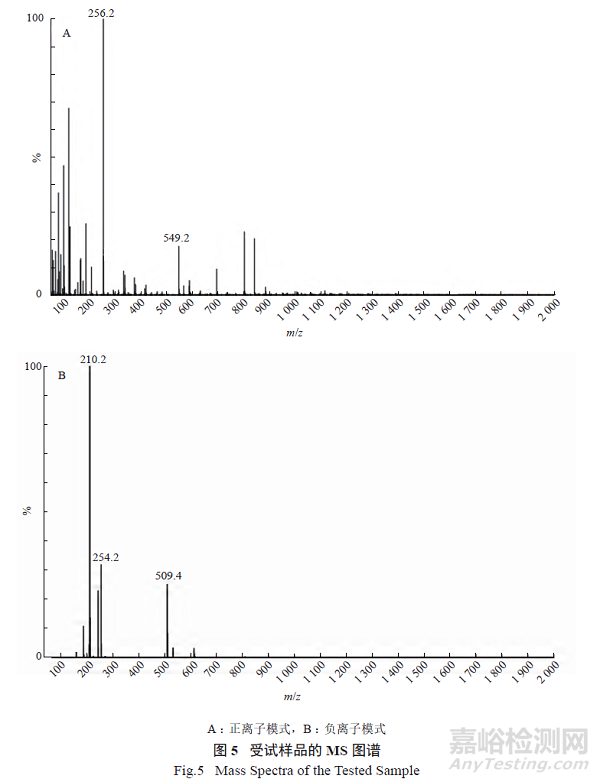
2.1.4 质谱(MS) 分析
将受试样品制成甲醇稀溶液,按照《中华人民共和国药典》2020 年版(ChP 2020) 四部通则0431质谱法进行检测,设置离子模式为电喷雾离子源(ESI),扫描方式为全扫描模式。受试样品在正离子模式及负离子模式下的MS 测试图见图5,数据分析见表3。结果显示,正离子模式下的质谱出峰(256.2) 和负离子模式下的质谱出峰(254.2) 来自于受试样品在质谱条件下解离成酮咯酸的出峰信号;负离子模式下的质谱出峰(509.4) 来自于受试样品在质谱条件下解离成酮咯酸二倍体的出峰信号。以上分析结果与受试样品—— 酮咯酸钙的相对分子质量与分子式一致。
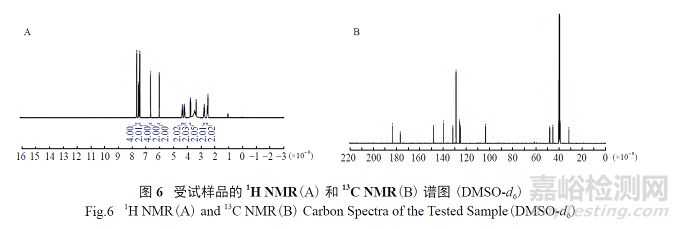
2.1.5 核磁共振(NMR) 分析
将适量受试样品溶解于DMSO-d6 约0.5 ml 中,进行如下NMR 检测:1H NMR、13C NMR、COSY、HSQC、HMBC 分析。样品的核磁共振1H NMR、13C NMR 谱图见图6,NMR 谱图信息显示样品结构与酮咯酸钙结构信息相符。
2.2 微粒的结构分析
综合上述检测结果, 推断1 注射液中可见微粒的生成与钙有明显关系,推断该物质可能为酮咯酸钙,相对分子质量为548.61,分子式为C30H24CaN2O6,其结构式如图7 所示。
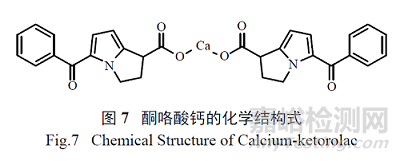
2.3 酮咯酸钙的来源分析
通过分析注射剂生产过程中的关键工艺控制点,推测酮咯酸钙的生成可能与注射液所用包装系统有关。目前上市的1 注射液包装系统多为玻璃安瓿或玻璃管制注射剂瓶,经研究表明,1 注射液在长期贮存过程中,玻璃瓶( 玻璃安瓿及玻璃注射剂瓶) 中的钙会不断迁移出来,与注射液中的酮咯酸不断结合,从而形成酮咯酸钙微粒。
2.4 微粒控制方法研究
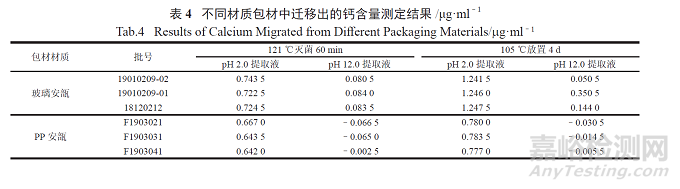
为避免此类现象的发生,本研究分别对玻璃瓶与PP 安瓿中的钙含量进行对比研究,选用不同编号的玻璃安瓿与PP 安瓿,分别用pH 2.0 盐酸提取液( 量取浓盐酸0.9 ml,用水稀释至1 000 ml) 和pH 12.0 氢氧化钠提取液( 称取氢氧化钠0.4 g,用水稀释至1 000 ml) 经不同的方式处理( 见表4,所列均为扣除不加任何钙元素的空白后的数据),测定钙含量。结果显示,玻璃安瓿中迁移出来的钙含量远高于PP 安瓿。因此为抑制酮咯酸钙的形成,包材应选择钙含量低的PP 安瓿。
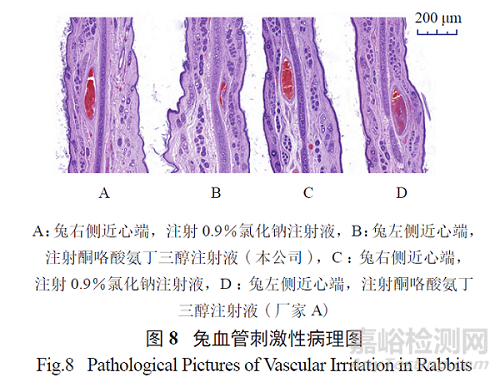
2.5 兔血管刺激性试验
对本公司生产的1 注射液( 批号F1903021-1,包材材质为PP 安瓿,注射液中无颗粒物) 和厂家A( 批号93090DK,包材材质为玻璃瓶,注射液中有颗粒物) 生产的1 注射液进行兔血管刺激性试验,采用同体左右侧自身对照方法,耳缘静脉推注给药,给药频率为每日2 次,共给药5 日。结果见图8,
3、讨论
经异物检查和数据推断,注射液中的微粒可认为是药液中的酮咯酸与玻璃瓶中迁移出来的钙反应生成的酮咯酸钙,由于酮咯酸钙的生物活性未知,并不能排除其对人体造成的影响。但此类异物的存在,对注射液使用时的安全性造成了一定影响,故应在药物生产和使用过程中给予重视,若在临床使用时发现可见异物,应立即停止使用。此外,应用先进的仪器分析技术对可见异物进行结构和定性分析,具有一定的科学性、可行性和有效性。

来源:药研


