您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2022-08-05 10:45
更多医药技术资讯,请点击医药专栏:http://drug.anytesting.com/ 欢迎关注文末微信公众号:药研检测drugtest
今日头条
国内药讯
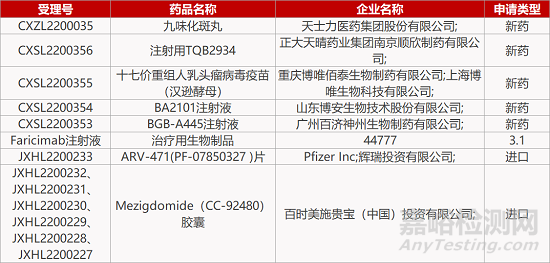
1.罗氏长效眼科双抗在华报产。罗氏Faricimab注射液的3.1类生物制品上市申请获CDE受理。Faricimab(Vabysmo)是首个针对眼科疾病开发的VEGF-A/ANG-2双抗,已于今年1月获FDA批准上市,用于治疗湿性年龄相关黄斑变性和糖尿病黄斑水肿。与单纯anti-VEGF疗法相比,Faricimab用干治疗多种视网膜疾病可以实现减少眼部注射给药频率,每4个月注射1次,改善患者的远期视力结局。
2.泽璟JAK抑制剂IIb期临床积极。泽璟制药新型JAK抑制剂盐酸杰克替尼片在用于芦可替尼不耐受的中、高危骨髓纤维化(MF)的关键IIb期临床(ZGJAK006)达到主要研究终点。独立影像学(IRC)评估的24周时脾脏体积较基线缩小≥35%的患者比例为43.2%,达到预设的统计学标准。此前,该新药已在一线治疗中、高危MF的III期临床中获积极结果。泽璟制药计划尽快提交该新药用于上述两个适应症的上市申请。
3.艾伯维c-Met靶向ADC启动肺癌III期临床。艾伯维靶向c-Met 的ADC新药Telisotuzumab Vedotin在国内登记启动一项III期临床研究,比较Telisotuzumab Vedotin(ABBV-399)和多西他赛治疗既往接受过治疗的c-Met过表达、EGFR野生型、局部晚期/转移性非鳞状非小细胞肺癌的有效性和安全性。今年1月,该新药已获FDA授予用于治疗NSCLC的突破性疗法认定。在一项II期LUMINOSITY研究中,Teliso-V在EGFR野生型非鳞癌组ORR为36.5%,其中,高度和中度c-Met过表达人群的ORR分别为52.2%和24.1%;EGFR 突变型非鳞癌组和鳞癌组的ORR则相对较低,分别为11.6%和11.1%。
4.歌礼新冠口服药获FDA临床许可。FDA批准歌礼制药新冠口服候选药物聚合酶(RdRp)抑制剂ASC10的新药临床试验(IND)申请,将直接在轻中度新冠患者中开展Ib期、安慰剂对照临床试验,评估ASC10多剂量递增(200毫克、400毫克或800毫克,每日两次)的安全性、耐受性、药代动力学和初步疗效数据,治疗期为5.5天,观察期为28天。ASC10是一款口服双前药,同单前药莫努匹韦相比具有新的差异化的化学结构。
5.辉瑞ER靶向PROTAC在华报IND。辉瑞从Arvinas公司引进的ER靶向PROTAC蛋白降解疗法ARV-471(PF-07850327 )片的临床试验申请获CDE受理,拟用于乳腺癌的治疗。该新药在海外的开发处于Ⅱ期临床阶段。公布于2021 SABCS年会上的一项用于治疗ER+/HER2-局部晚期或转移性乳腺癌患者的临床数据显示,ARV-471在可评估患者中的临床获益率达到40%,其中3例达到PR(另有1例未证实PR),ORR为7.89%(3/38)。
国际药讯
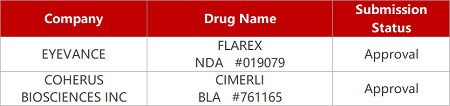
1.雷珠单抗可互换生物类似药获FDA批准。FDA批准Coherus BioSciences公司雷珠单抗生物类似药CimeriI作为诺华Lucentis的可互换生物类似药,可用于Lucentis在美国获批的所有适应症,包括湿性年龄相关性黄斑变性、视网膜静脉阻塞继发黄斑水肿、糖尿病黄斑水肿、糖尿病视网膜病变和近视性脉络膜新生血管形成。Cimerli最初由Bioeq开发,Coherus通过授权获得Cimerli在美国的独家权益。2021年,雷珠单抗美国销售额为13.53亿瑞士法郎。
2.RNAi疗法ATTR-CM的Ⅲ期临床积极。Alnylam公司RNAi疗法patisiran治疗伴有心肌病的转甲状腺素蛋白介导的淀粉样变性(ATTR-CM)患者的Ⅲ期临床达到主要终点。patisiran治疗12个月后,患者的6分钟行走检测结果较基线的变化显著优于对照组(p=0.0162)。该试验也达到健康相关生活质量指标等次要终点。在由全因死亡和心血管事件构成的复合次要终点方面,patisiran治疗未显示出统计显著差异(p=0.0574)。
3.现货型干细胞疗法获FDA优先审评。Gamida Cell公司开发的“first-in-class”干细胞疗法omidubicel的生物制品许可(BLA)申请获FDA受理,用于治疗需要同种异体造血干细胞移植的血癌患者。FDA同时授予其优先审评资格,PDUFA日期为明年1月30日。在一项Ⅲ期临床中,与使用标准脐带血移植的对照组患者相比,omidubicel组患者中性粒细胞植入时间显著缩短(12天vs22天,p<0.001);血小板植入、感染率等所有次要终点具有统计学意义。
4.罗氏60亿美元布局现货型CAR-T。罗氏与Poseida Therapeutics将利用后者的DNA修饰系统piggyBac技术平台,合作开发“现货型”同种异体CAR-T疗法,治疗多发性骨髓瘤、B细胞淋巴瘤与其他血液适应症。根据协议,Poseida会获得1.1亿美元的预付款以及最高达1.1亿美元的近期里程碑与其他款项。加上未来开发与商业化里程碑,Poseida总计可获得高达60亿美元的付款。罗氏将拥有合作CAR-T项目的开发与商业化选择权,包含处于Ⅰ期临床拟用于多发性骨髓瘤的P-BCMA-ALLO1,以及临床前期拟用于B细胞淋巴瘤的P-CD19CD20-ALLO1。
5.艾伯维再次布局GPCR小分子新药。艾伯维扩大与Sosei Heptares的合作并签订新的合作和许可协议,将利用Sosei Heptares的StaR技术和基于结构的药物设计(SBDD)平台,合作开发调节与神经系统疾病相关的新型G蛋白偶联受体(GPCR)小分子候选药物。根据协议,Sosei Heptares将获得4000万美元的预付款,高达12.4亿美元的潜在期权、开发和商业里程碑付款,以及产品的分成。艾伯维将拥有最多3个候选品种的独家选择权,负责候选药物的临床、监管和商业开发。
6.再生元新冠鸡尾酒终止临床研究。再生元日前终止了新冠中和抗体Ronapreve(REGEN-COV,卡西瑞单抗+伊德单抗)的4项临床试验,分别为用于治疗12岁以下高危新冠患者的IIa期临床;用于治疗新冠住院儿童患者的Ia期临床;用于在免疫功能低下的青少年和成人中预防新冠效果的III期临床;以及用于治疗新冠门诊患者的临床。根据ClinicalTrials.gov官网的更新信息,终止的原因是REGEN-COV对omicron变体失效。
医药热点
1.北京加强医疗机构科研诚信管理。8月1日,北京市卫健委印发《北京市加强医疗卫生机构科研诚信管理实施方案》,要求建立健全北京地区医疗卫生机构(含医疗机构、疾病预防控制机构、采供血机构、妇幼保健机构)科研诚信管理体系,推动职责清晰、协调有序、监管到位的科研诚信工作机制有效运行,规范医学科研行为,为建设国际科技创新中心奠定坚实基础。
2.河南拟招2000名助理全科医生。近日,河南省举行2022年助理全科医生培训理论招收考试。今年,该省计划招收2000名助理全科医生(含100名“3﹢2﹢1”卓越助理全科医生),共有3479人报名。助理全科医生培训实行脱产学习,为期两年,今年该省共有57家培训基地为招收单位。
3.安徽省儿童骨科联盟成立。7月31日,安徽省儿童骨科联盟成立大会在安徽省儿童医院召开。安徽省儿童骨科联盟是由复旦大学附属儿科医院安徽医院 (安徽省儿童医院)儿童骨科组织发起,全省共73家医院加入联盟。安徽省儿童骨科联盟旨在有效解决安徽省儿科医疗资源相对不足,分布不均衡的问题,并通过共建、共享,全面提升全省儿童骨科诊疗水平,实现优质医疗资源扩容和区域内同质化发展。
评审动态
1. CDE新药受理情况(08月04日)
2. FDA新药获批情况(北美08月02日)

来源:药研发


