您当前的位置:检测资讯 > 法规标准
嘉峪检测网 2022-05-13 23:11
一、什么是过程确认?
通过提供客观证据,证明过程(或工艺)能够持续地产生符合预定要求的产品或结果。——「过程确认指南 GHTF/SG3/N99-2004 第二版」
法规或标准
对于过程确认的要求
《医疗器械生产质量管理规范》与其他法规标准对比用词不一样(特殊过程),但实质上与其他法规和标准要求是一致的。特殊过程:指通过检验和试验难以准确评定其质量的过程。
二、如何判断某个过程需要过程确认?
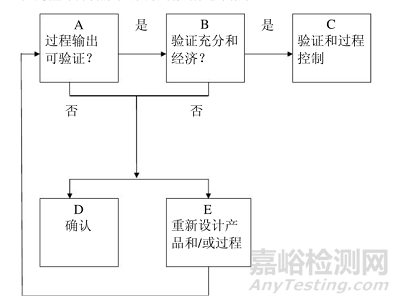
图1 过程确认判断树(引用自GHTF/SG3/N99-2004)
使用这个图:
从A开始判断,如果是,则到B继续判断,如果还是,则到C
如果从A开始结果为否,则有D和E两个结果,通常会选择D,当然也可以E重新设计产品或过程,以消除偏差,改进产品或过程。通过重新设计产品或过程,可以用简单的验证得出接受与否的结论,这样风险或成本可以得到控制。
如果A判断结果为是,但B判断结果为否,则有D和E两个结果供选择,一般情况下选D。
三、过程确认怎么做?
一般分为三个阶段:
1. 安装确认(IQ):用客观证据证明 设备被正确安装,符合制造商批准的规范和/或设备供应商建议的规范。对所用设备和必要的服务提供的确认;
2. 运行确认(OQ):用客观证据证明,与产品有关的过程控制限度范围符合所有预先设定的要求。证明过程可以生产合格的产品,并建立过程参数的控制极限;
3. 性能确认(PQ):用客观证据证明,在预期条件下,过程可以连续地产出符合所有的要求的产品。建立长期的过程稳定性。
附表:
|
法规或标准 |
对于过程确认的要求 |
|
《医疗器械生产质量管理规范》 |
第四十九条 企业应当对生产的特殊过程进行确认,并保存记录,包括确认方案、确认方法、操作人员、结果评价、再确认等内容。 生产过程中采用的计算机软件对产品质量有影响的,应当进行验证或者确认。 |
|
ISO13485:2016 |
7.5.6 当生产和服务提供过程的输出不能或不是由后续的监视或测量加以验证,并因此使问题仅在产品使用或服务交付后才显现时,组织应对任何这样的过程进行确认。确认应证实这些过程具有稳定地实现所策划的结果的能力 。 组织应将过程确认程序形成文件,过程确认包括 : a) 为过程的评审和批准所规定的准则 ; b) 设备鉴定和人员资格鉴定 ; c) 使用特定的方法、程序和接收准则; d) 适当时包括包含样本量原理的统计技术; e) 记录的要求(见4.2.5); f) 再确认,包括再确认的准则; g) 对过程更改的批准。 组织应将用于生产和服务提供的计算机软件应用的确认程序形成文件。此类软件的应用在首次使用前应予确认,适当时,此类软件或其应用更改后也应予确认。有关软件确认和再确认的特定方法和活动应与软件使用有关的风险(包括对产品符合规范的能力的影响)相适应。应保留确认的结果和结论以及确认所采取的必要措施的记录(见4.2.4和4.2.5) |
|
美国QSR 820 |
820.75 (a)当过程结果不能为其后的检验和试验充分验证时,过程应以高度的把握予以确认,并按已确定的程序批准。 (b)各制造商应建立并保持关于检测和控制确认过程的过程参数的程序,以保证持续达到指定的要求。 (1)各制造商应保证由限定的人完成确认过程。 (2)确认过程,监测和控制方法及数据,执行日期,必要时完成确认过程的操作者或使用的主要设备均应记录在文件中。 (c)当过程确认发生变化或偏差时,制造商应检查并评价过程确认,必要时要使其再确认。有关内容应记录在文件中。
|

来源:苏州市医疗器械行业协会


