您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2022-04-28 14:44
[摘要] 肺部给药系统具有起效快、疗效好、同时减少不良反应等优点,已成为一种倍受关注的给药方式。在全球新型给药系统药物市场中,肺部吸入给药系统占有极为重要的地位,特别是在慢性阻塞性肺病和哮喘等与呼吸道相关疾病的治疗方面具有广泛的临床应用价值。本文将从吸入制剂的最新分类、美国FDA已上市产品情况和创新性产品研究进展等方面入手,对目前最新的吸入制剂进行综述,为今后肺部吸入制剂的研发创新提供思路和启发。
将特定药物直接递送至肺部或以肺部为媒介,药物经患者主动或被动吸入后实现局部或者系统疾病的治疗统称为肺部给药系统( pulmonarydrug delivery system,PDDS) 。肺部给药技术巧妙地结合气溶胶技术与呼吸系统的解剖、生理、组织学特点,利用特定的给药装置,将气溶胶形式(粉雾、气雾、吸入雾状液滴等) 的治疗药物经呼吸道递送至肺部。相比传统的给药方式,肺部给药具有快速、高效、患者依从性好的优势。近年来,随着空气污染的日益加重、人口老龄化程度持续加深,致使呼吸系统疾病患病率不断上升,肺部吸入给药已成为一种倍受关注的给药方式。本文就肺部给药系统特点、吸入制剂的剂型分类、美国FDA已上市产品情况和代表性产品研究进展等进行综述。
1肺部给药系统特点
目前,作为非侵犯性药物递送技术的肺部给药系统是治疗肺部疾病最直接有效的给药途径,其对于肺部疾病来说是一种局部的给药方式,能够直接、快速地提高治疗部位药物浓度并降低系统浓度。而对于某些全身治疗作用的药物来说,因肺部肺泡数量众多(约有3~4亿个上皮细胞,总面积可达70 ~100m2 )[1],毛细血管数量巨大,血流量丰富,且有高通透性的毛细血管分布在相邻肺泡的2层上皮细胞膜之间,使药物易通过肺泡表面快速吸收进入体循环,可以同时起到全身的治疗作用[2]。
与口服给药方式相比,肺部给药吸收速度快、生物代谢酶分布集中、化学降解和酶降解反应较低,可减少蛋白质、多肽等大分子类药物的降解,使药物透过肺泡表面被快速吸收入血的同时保持其生物活性。而相比于注射给药这种损伤性给药方式,肺部给药极大地提高了患者顺应性,可适用于需进行长期治疗的患者[3]。同时,肺部局部给药因可直接把药物递送至肺部,从而广泛应用于治疗如哮喘或囊肿性纤维化等肺部疾病[4],这种靶向给药方式直接递送药物至肺部,降低了药物的给药剂量和减少了全身给药所带来的不良反应。另外,正是由于肺部能迅速吸收药物进入体循环,因而肺部吸入给药制剂可实现淋巴靶向、局部靶向或全身吸收等多重作用[5-6] 。Tseng 等[7] 通过发现经表皮生长因子( epi⁃dermal growth factor,EGF)修饰后的肺部吸入纳米粒可主动靶向EGF受体表达过的肿瘤细胞,证明了吸入纳米粒子可以穿越肺部到达肿瘤,并在肿瘤部位富集。
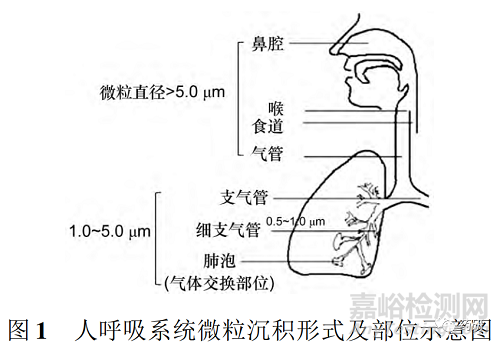
药物在呼吸系统沉积形式及部位主要受微粒直径的影响(见图 1) ,直径 > 5.0μm 的微粒会因粒子间惯性碰击而沉积在咽喉及上呼吸道位置;直径在1.0~5.0μm 之间的微粒主要会以重力沉积形式到达呼吸道深部,沉积在气管、支气管和肺泡表面;直径0.5~1.0μm 的粒子沉积于呼吸性细支气管及肺泡壁;而直径 <0.5μm 的粒子,通常有80%会因布朗运动随气流被呼出体外,基本无法在呼吸道沉积。经研究发现,直径在1.0~3.0μm 的粒子在总粒子中占的比例越大,其在肺泡和细支气管内沉降率就越高,疗效也就越好[2]。
2吸入制剂的分类及FDA已上市产品
吸入制剂系指原料药物溶解或分散于合适介质中,以气溶胶或蒸汽形式递送至肺部发挥局部或全身作用的液体或固体制剂。处方中可能含有抛射剂、共溶剂、稀释剂、抑菌剂、助溶剂和稳定剂等,所用辅料应不影响呼吸道黏膜或纤毛的功能[8]。一直以来,关于吸入剂类别的划分都存在诸多争议,大部分人把吸入剂划分为雾化吸入剂、定量吸入气雾剂( metered⁃dose inhalation aerosol,MDI) 、干粉吸入剂( dry powder inhalant,DPI) 和软雾剂。也有少部分人根据其能量来源的不同,将用于临床的吸入剂归为喷雾剂、雾化液、定量吸入气雾剂、干粉吸入剂、软雾剂和挥散吸入剂。目前,《中华人民共和国药典》2020年版最新征求意见稿中将吸入制剂划分为气雾剂、吸入粉雾剂、吸入喷雾剂、吸入液体制剂和可转变蒸汽的制剂。值得注意的是,可转变蒸汽的制剂首次被药典定义与划分,而吸入液体制剂还包括吸入溶液、吸入混悬液、吸入用浓溶液(需稀释后使用的浓溶液) 、吸入用粉末(需溶解后使用的粉末)[10]。为方便读者能对目前FDA已上市(截至2020年4月9日)吸入制剂有更进一步的了解,笔者分别按照剂型分类对产品及所有辅料进行了规整总结(因篇幅有限,故有些仅陈列了近5年或近10年产品) 。
2.1 吸入气雾剂
吸入气雾剂又称MDI,系指含药混悬液、乳液或溶液,与液化混合抛射剂或合适抛射剂共同装封于具有一定压力和定量阀门系统的耐压容器中,使用时借助抛射剂的压力,将内容物呈雾状物喷出,用于肺部吸入的制剂。必要时可适当添加稳定剂、增溶剂和共溶剂[8] 。MDI具有稳定性好、作用迅速和使用方便等优点。该种制剂把药物密封在耐压容器中,与外界(如空气等) 隔绝药物,进而保证了药物的稳定性[9]。同时,其能通过定量阀门控制药物剂量,具有定位和速效作用,并且价格便宜、装置简单易于携带。然而,MDI需要患者在药物喷射的同时配合吸气,喷射需在10~20s内完成,即有必要对患者进行吸入与装置启动的协调一致的使用培训。吸入气雾剂的触发也需要与患者的呼吸相配合,近50% 的患者尤其是老人和儿童对装置使用的协调性很差[10]。另外,通常只有10%~20% 喷出的药物有效地沉积于肺部, 故药物的传递效率较低[11]。较重要的是,MDI处方中需加入抛射剂,这会带来环境问题和可能使悬浮在抛射剂中的药物晶体形成更大的絮状物,进而影响药物稳定性和均一性。Ferguson 等[12] 应用共混悬技术提高定量吸入气雾剂的稳定性和均一性。为解决抛射剂会带来环境污染的问题,1986年发布的《蒙特利尔协议》限定了含氟氯烷吸入气雾剂的发展和应用。2006年之后,人们逐渐淘汰了普遍用作抛射剂但破坏大气臭氧层的氟利昂,改用了不破坏臭氧层的四氯乙烷和四氟乙烷等进行替代[13]。李丁等[14] 使用四氯乙烷替代氟利昂作为丙酸倍氯米松吸入气雾剂中的抛射剂。意大利 Chiesi 公司研发的 Modulite 专利技术亦采用氢氟烷( hydrofluorane,HFA)作为抛射剂。但这些替代剂会产生严重的温室效应,环境问题仍然存在。所以解决抛射剂的环境问题,预计会是未来研发的重点[15]。目前,吸入气雾剂制剂研发的难点在于产品质量属性影响因素很多,特别是对于混悬型气雾剂。除了原辅料属性、处方组成和用量等处方因素外,罐体特别是阀门和促动器影响也很大。此外,国内的设备和技术比较落后,对于有些合适的内容物处方,设备或工艺上难以实现,产业化困难。表 1 对近10年FDA已上市吸入气雾剂及目前吸入气雾剂所用辅料进行了总结( 在市产品共 13个) 。

2.2 吸入粉雾剂
吸入粉雾剂又称DPI,系指固体微粉化原料药物单独或与合适载体混合后,以泡囊、胶囊或多剂量贮库形式,采用特制的干粉吸入装置,由用药者吸入雾化药物至肺部的制剂[8]。吸入粉雾剂是在定量吸入气雾剂的基础上,综合粉体工学的知识而发展起来的一种新型制剂[16] 。1986年发布的《蒙特利尔协议》限定了含氟氯烷吸入粉雾剂的发展和应用,DPI作为有效的替代方式得以快速发展[19]。吸入粉雾剂的药物粉末进入体内的动力来源于患者的自主吸气或由患者吸气而启动装置递送药物( 如机械动力、电力等) ,故消除了协同困难[17]。另外,其不使用抛射剂,避免了抛射剂对环境的破坏,不使用压力容器又使得装置简单易用易携带,患者的顺应性好[18],并且粉末制剂使蛋白质和多肽药物不受溶解度的影响,稳定性好,载药量高。但因药物为粉末,易发生吸潮,因而对所用包装材料要求高[19]。且吸入粉雾剂的效能、临床有效性及吸入剂量不仅与处方及药物本身性质有关,还与给药装置密切相关[20]。其不同公司、不同品种的产品递药原理、装置设计和使用方法完全不同,每个产品类似于一个新“剂型” ,易造成患者的使用困惑。
粒子与粒子、粒子与吸入装置之间的气动碰撞与摩擦关系是吸入粉雾剂开发的主要难点。一般微粒的空气动力学直径小于5μm,且有好的流动性,有利于吸入粉雾剂的精确定量和提高药物的肺部递送效率。通常改善粉末流动性的常用方法为把药物与载体混合,如葡萄糖、乳糖以及新兴的富马酰基二酮哌嗪(fumaroyl diketone piperazine,FDKP)、二棕榈酰磷脂酰胆碱(dipalmitoyl phosphatidylcholine,DPPC)或制成疏松聚集物。改变微粒的空气动力学直径的方法是把药物微粉化,传统微粉化为研磨粉碎,但这样所制备的粒子电荷高,黏附性大。而传统制备技术的不足促进了新技术的发展,如今研究最多且较为成熟的技术如超临界流体技术、喷雾干燥、高重力控制沉淀法、冷冻干燥法等[21]。李核成[22] 采用喷雾干燥技术制备硫酸特布他林干粉吸入剂,并进行处方工艺优化,结果使所得吸入粉雾剂的空气动力学粒径均在1.70~1.90μm,重现性良好且性质优异。Bi等[23]利用冷冻干燥技术对胰岛素脂质体进行微粉化提高干粉吸入剂的肺部沉积率,增加生物利用度。目前,FDA已上市(且在市)吸入粉雾剂品种共为24种,表2仅列出近5年产品及所有辅料。

2.3 吸入液体制剂与可转变成蒸汽的制剂
吸入液体制剂系指供雾化器用的液体制剂,即通过雾化器产生连续供吸入用气溶胶的乳液、混悬液或溶液,吸入液体制剂包括吸入溶液、吸入混悬液、吸入用溶液(需稀释后使用的浓溶液)或吸入用粉末(需溶解后使用的粉末)[8]。其相比于口服制剂具有见效快、用量小、不良反应少等特点,且处方简单,所用溶剂或分散介质通常为注射用水,常添加有等渗调节剂(氯化钠) 、缓冲盐(柠檬酸⁃柠檬酸钠) 、金属螯合剂[乙二胺四乙酸二钠( disodium ethylene diaminetetraacetate,EDTA⁃2Na) ] 、 pH 调节剂 ( 氢氧化钠) 等[24],必要时可加入少量的乙醇或丙二醇增加药物的溶解度。对于药物水溶性较低而需要制备成吸入混悬液的,处方中通常需要加入适量的表面活性剂(如吐温类)作为稳定剂和分散剂[22]。相较于气雾剂、粉雾剂的单次给药剂量较小,吸入液体给药可以将含有药物的悬浮液或溶液雾化成大剂量的小液滴,且不受患者呼吸行为的影响,适用范围广,儿童、老人都可以使用[15]。目前,吸入液体给药已广泛应用在临床上,用于此剂型的药物除了传统的平喘药、抗生素、麻醉药、镇咳祛痰药外,也还有部分中药制剂[24]。
与气雾剂和粉雾剂不同,处方因素对雾化吸入剂的影响较小,雾化器的雾化效率对其影响较大。传统的吸入液体制剂不仅在雾化过程中容易二次暴露,造成患患和医患之间的交叉污染[25],而且因雾化器体积的限制(局限在医院使用) ,通常治疗时间较长,患者依从性较低。而近年来,雾化器已逐渐向便携化、智能化发展[26],且因在治疗患有慢性阻塞性肺疾病( COPD) 、哮喘的老年人及儿童患者时,疗效明显优于气雾剂和粉雾剂,吸入液体制剂得到越来越广泛的研究[19]。雾化器类型较多,按照工作原理大致可分为喷射雾化器、超声雾化器和振动筛雾化器等[27]。喷射雾化器在相同的治疗时间内吸入的雾化量适宜,不易造成缺氧、呛咳。雾化的颗粒也更细,可以深入下呼吸道的治疗,现国内临床大多采用喷射雾化器。但其存在残留体积大、噪音大的不足。与喷射雾化器不同,超声雾化器的雾化过程不受患者呼吸行为的影响,还可根据患者的病情来调整雾滴大小和雾化速率等,但因超声雾化可能会破坏蛋白质等生物大分子以及热敏性药物的结构,对于黏度较大的药液以及微米混悬液雾化效果不佳、不良反应发生率较高等多方面的原因[28],现已基本被淘汰。相比于超声式雾化器和喷射式雾化器,振动网雾化器能雾化小体积的剂量(最低到达0.5mL) ,且药液残留低,药物利用率高,雾化过程中药液温度无显著变化,更适于雾化生物大分子等稳定性差的药物[29],但技术复杂,需激光打孔,因而成本相对较高。随着吸入治疗在临床上的应用日趋广泛,针对各种不同需求的雾化器产品应运而生,目前已研究出智能雾化系统,该系统与振动型或喷气型雾化器相连,可实现靶向与准确定量给药[30]。新研究的便携手持式雾化吸入剂也有望与市场上的定量吸入气雾剂、粉雾剂竞争[31]。
可转变成蒸汽的制剂系指可转变成蒸汽的溶液、固体或混悬液制剂,通常是将其加入热水中,产生供吸入用的蒸汽[8]。其不涉及使用其他辅料,目 前 FDA已上市的此类制剂共20个,新药11个,仿制药9个,其中新药8个已撤市,仿制药则全部处在撤市停产状态。目前仅3个产品(商品名为活宁、优宁、悦坦) 在市场流通,且此类制剂全部用于麻醉。表 3 对目前FDA已上市吸入液体制剂与可转变成蒸汽的制剂关键信息进行了总结。


2.4 吸入喷雾剂
吸入喷雾剂是一种传统的给药方式,系指通过预定量或定量雾化器产生供吸入用气溶胶的溶液、混悬液或乳液。使用时借助手动泵的压力、超声振动、高压气体或其他方法将内容物呈雾状物释出,可使一定量的雾化液体以气溶胶的形式在一次呼吸状态下被吸入[8]。其既有雾化给药的特点,又避免了使用抛射剂,成本较低、起效迅速、使用方便且安全可靠,但因喷出的雾滴较大而需要的药液量大[32]。目前,临床应用较多的是鼻用喷雾剂。而本文讨论的为肺部吸入给药,所以对于鼻用喷雾剂并不过多论述。
吸入喷雾剂与吸入溶液所用的雾化器原理一样,但设备较简便易携带,在这里就不过多阐述。现今,我国也发挥了医药组方的优势,研发出种类较多、覆盖范围广、疗效确切、临床应用方便、得到普遍认可的中药喷雾剂,但仍面临重大挑战,如成分复杂、配方粗糙、质量标准不高、工艺受影响因素过多等[33] 。FDA已上市吸入喷雾剂见表 4。

3吸入制剂最新研究进展
3.1 适应证的拓展———以肺为通道作用全身产品
全球上市的吸入产品 80% 以上均是起局部作用,主要用于支气管哮喘和COPD的防治。截至2020年3月,已有3个在市产品(吸入粉雾剂) 是以肺为通道,通过肺泡表面进入体循环,起到全身治疗作用。由 Alexza 公司生产的洛沙平( Adasuve,10 mg) 是FDA批准的第一个采用吸入器给药的治疗存在激越症状的精神分裂症和双相情感障碍类药物。它于2012年 12月21日批准上市,主要通过中枢多巴胺D2和5⁃羟色胺(5⁃HT2A )受体拮抗作用介导。其最大血浆浓度(Tmax)的中值时间为2min,在给药后最初2h的暴露量(AUC0 - 2h )为 66.7ng·h·mL-1。因其吸收非常迅速,洛沙平的早期血浆浓度存在很大差异。服用后的平均血浆洛沙平浓度在临床剂量范围内呈线性,AUC0-2h ,AUCin和Cmax呈剂量依赖性增加。有临床试验结果证明,在给药2h时间点及主要次要终点,与安慰剂对照组患者相比,Adasuve 显著地减少了躁动症发病次数,差异具有统计学意义,从而达到主要观察终点[34]。也有研究显示,Ada⁃suve 给药10min后,激动症患者发病次数就显著降低。另外,本品为未加其他辅料的制剂,其关键在吸入器的使用(通过加热使药物升华后再形成冷凝气溶胶) 。Adasuve 以其使用方便、效果显著、吸收迅速等优势为吸入给药治疗精神疾病打开了一条新路径。但洛沙平可能引起支气管痉挛、哮喘或 COPD 患者呼吸窘迫或心搏骤停,因此,该处方药目前只能在部分医疗保健机构中使用[35] 。2020年2月,由兆科药业(合肥)有限公司申办了其在国内的临床试验。
全球首个吸入胰岛素(商品名 Exubera)由辉瑞公司开发,于2006年1月26日获美国FDA批准,但由于产品本身设计不被患者接受以及临床上存在诸多的安全性担忧,上市后销售业绩欠佳,于是在2008年退出市场。继 Exubera 撤市之后,2008年诺和诺德和礼来公司分别宣布终止开发其已处于Ⅲ期临床研究的速效吸入胰岛素产品AERxiDMS和胰岛素吸入粉雾剂AIR的开发[35] 。Afrezza 是一种人造速效吸入式胰岛素,由 Mannkind 公司开发,在经历了2次 FDA拒绝之后,充分分析了 Exubera 失败的原因并基于其问题进行了改进,Afrezza 终于在2014年6月获得FDA批准上市。Afrezza 在吸入后与肺表面接触迅速吸收而起作用,用于控制糖尿病成人患者的高血糖(具体为通过刺激骨骼肌和脂肪的外周葡萄糖摄取,并通过抑制肝葡萄糖生成来降低血糖水平) 。它已被证实可以帮助控制1型和2型糖尿病患者的血糖水平。其给药后12~15min即达血药峰浓度,消除半衰期为28~29min,全身胰岛素暴露时间为 180min,显著短于皮下注射给药的6h,相对生物利用度为21% ~30% 。因起效快,该制剂可于餐前或餐后20min 内给药[31]。临床试验证明,对于治疗1型糖尿病,用 Afrezza 进行治疗后糖化血红蛋白( HbA1c)平均降低,符合预先规定的0.4% 的劣效边缘。而与门冬胰岛素相比,Afrezza提供的HbA1c减少较少,且差异具有统计学意义。
对于治疗2型糖尿病,口服降糖药物血糖控制不佳的患者使用 Afrezza 治疗24周, HbA1c 水平下降0.4% ,餐后血糖水平和波动分别降低 43% 和56% 。使用胰岛素(联用或不联用口服降糖药) 血糖控制不佳的患者随机接受治疗,吸入胰岛素组HbA1c下降幅度不劣于预混胰岛素组,吸入胰岛素降糖作用不及皮下注射胰岛素,但严重低血糖发生率少,体重增加少于皮下注射胰岛素。因此,Afrezza提供了更容易接受的胰岛素使用方式、更少的体重增加、更低的低血糖风险和更大的适应患者不同生活方式的可能性。另外,在制剂制备方面,其采用了新型辅料无毒性FDKP,利用其在微酸的介质中能通过氢键结合自组装成粒径2~5μm 的高内部孔隙率微球的特点,制备成微晶粒(平均直径2.5μm,略显酸性),然后把胰岛素粉加入至FDKP微球溶液中,使胰岛素吸附在FDKP颗粒上,再经冷冻干燥,制成吸入粉雾剂[36],并且其吸入器体积小,易于使用和携带,但在哮喘或慢性阻塞性肺病患者中可引起急性支气管痉挛。
Inbrija从最初被拒到2018年12月2日获得批准,前后经历了长达11年之久,该药的获批是帕金森病治疗领域的一个重大进展。它是首个获FDA 批准的用于治疗帕金森病的吸入式药物。目 前,左旋多巴是帕金森病治疗的“黄金标准” ,其作用机制为左旋多巴穿过血脑屏障,进入中枢后转变为多巴胺(dopamine,DA),补充纹状体中DA的不足,而产生抗帕金森病的作用。Inbrija利用了Acorda公司专有的ARCUS 平台开发,旨在向患者肺部提供精确剂量的左旋多巴干粉制剂。其制备方法为把DPPC的溶解液(溶于乙醇中)和左旋多巴(加氯化钠)的水溶液混合后(搅拌至溶液澄清且无悬浮物)进行喷雾干燥,制得干粉颗粒[37] 。Inbrija 单次给药84mg,消除半衰期( t1/2 )为 2.3h,血浆平均达峰时间(Tmax)约为 0.5h(范围为0.17~2.00h) 。在禁食的健康志愿者中,与左旋多巴速释口服片剂相比,其生物利用度约为70% ,表观分布体积为168L。左旋多巴主要被多巴脱羧酶脱羧和儿茶酚氧甲基转移酶的氧甲基化( COMT)代谢。在口服的情况下,药物会先通过肠胃吸收再到达大脑,所以起效过程会有变化。而吸入式治疗可以通过肺部进入身体,直达大脑,绕过了消化系统。目前,已经有临床试验评估了 Inbrija 对轻度至中度帕金森病患者经历OFF期的有效性的Ⅲ期临床关键试验(一项为期12周、随机、安慰剂对照的双盲研究) 。结果显示,试验符合其主要终点,患者在第12周随访时显示运动功能在统计学上发生显著改善,通过统一帕金森病评定量表(UPDRS)第Ⅲ部分来衡量, Inbrija 给药84mg(n=114)与安慰剂(n=112)相比,给药后30min 两者的数值分别为-9.83分和-5.91分(P=0.009)。此外,Inbrija还开展了一项Ⅲ期长期、主动控制、随 机、开放标签研究( n=398) ,评估了1年内的药物安全性和耐受性。该研究显示,Inbrija组患者和观察组患者的一秒用力呼气容积( FEV1 )的平均降低幅度相同( -0.1L) [38]。
3.2 技术上的发展———突破产品超复杂制剂阿米卡星脂质体悬浮液
于 2018年9月18日获批上市的 Arikayce®(相当于硫酸阿米卡星623mg·8.4mL),使用由PARI Pharma GmbH生产的eFlow 雾化系统进行qd给药,用于治疗鸟型分枝杆菌导致的非结核分枝杆菌肺病。这是美国第一种专门用于治疗此肺病的方法。该产品使用电荷中性脂质体将阿米卡星直接送到肺部。在肺部药物会被NTM感染的肺巨噬细胞所吸收,延长了阿米卡星在肺部的释放,同时减少了全身暴露,从而降低了全身毒性,直接与静脉注射阿米卡星形成了差异化的优势。此前,FDA已授予Arikayce孤儿药资格、突破性药物资格以及合格传染病产品(QIDP)资格。其作用机制是通过结合30S核糖体亚单位来破坏和抑制靶细菌中的蛋白质合成。其药动学特点为患者在接受吸入治疗3个月后,平均血清AUC0-24值为23.5μg·h·mL -1(范围8.0~46.5μg·h·mL-1,n =12 ) ,平均血清Cmax 为2.8μg·mL-1 (范围1.0~4.4μg·mL-1,n =12) 。Cmax和AUC0-24值低于平均值(76μg·mL-1 和154μg·h·mL-1 ) 。血清中阿米卡星的蛋白结合率 ≤ 10% 。表观血清半衰期为5.9~ 19.5h。全身吸收的阿米卡星主要通过肾小球滤过消除,未被吸收的可能主要通过细胞更新和排痰来消除[39]。最值得注意的是,一直以来脂质体产品就以高技术门槛被列入经典的复杂制剂,虽然已有十几个脂质体产品上市,但均为注射制剂。另外,在吸入制剂方面,大剂量抗菌药几乎没有上市产品,而Arikayce的上市瞬间填补了这些方面空白。其制备方法为,在匀速搅拌下将溶解在乙醇中的脂质DPPC、胆固醇以一定流量注入到溶解在 0.9% 氯化钠溶液中的阿米卡星溶液中形成脂质体,接着将所产生的悬浮液用中空纤维筒进行透滤以除去乙醇和未包埋的阿米卡星,浓缩悬浮液至一定体积[40]。目前,Arikayce安全性和有效性在随机对照临床试验中得到证实,其中患者被随机分配到2个治疗组之一,一组患者接受Arikayce加上多药抗菌方案,而另一组患者单独接受多药抗菌方案。到治疗的第 6个月,29% 接受Arikayce治疗的患者连续3个月在痰培养中没有分枝杆菌生长,而未接受Arikayce治疗的患者仅为9% ,差异显著。
3.3 制剂的持续发展———代表性在研产品
目前,已有多种吸入产品在研,以下笔者选出较具代表性的MRT5005和PUR1900在研产品进行简单介绍。Translate Bio公司在研的用于治疗肺部囊性纤维化的mRNA 产品 MRT5005是作为第一次评估mRNA疗法治疗遗传性疾病的潜力药物,其为编码完整囊性纤维化跨膜传导调节因子(cystic fibrosis transmem⁃brane conductance regulator,CFTR)蛋白的mRNA,患者可通过手持式雾化器吸入,使mRNA进入肺上皮细胞,进而翻译产生功能性CFTR蛋白,减轻或治愈因CFTR蛋白功能异常引起的症状。另外,此种产品采用的是MRTTM平台技术,该技术平台生产mRNA产品的过程包括使用未修饰的碱基及进一步的序列优化合成表达目的蛋白的mRNA,如在mRNA的 5’ 端和 3’ 端加入非翻译区(UTR),以改善mRNA在细胞内的稳定性和翻译效率。将mRNA包装入递送载体中,如将mRNA包装入脂质纳米粒(lipid nano⁃particle,LNP)中,此平台产品稳定性好、免疫原性低。目前,Translate Bio 公司正在进行 MRT5005的双盲、安慰剂对照的Ⅰ/Ⅱ期临床试验( NCT03375047 ) 。针对MRT5005,Translate Bio公司也递交了涉及 mRNA活性成分、递送载体、mRNA与载体的组合物及使用这些组合物的方法等。
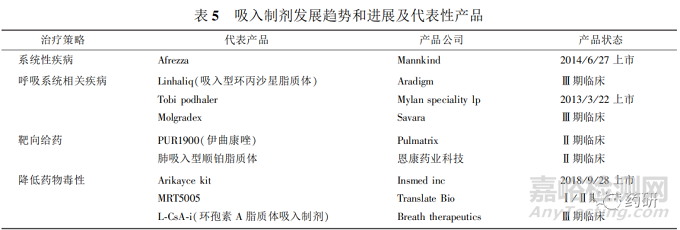
获美国FDA授予孤儿药资格的PUR1900(伊曲康唑)是正在研发的第一个吸入性的抗真菌药物,其用于治疗囊性纤维化及抗真菌感染,于2020年 1月30日获得FDA“快速通道”认证。PUR1900的制备工艺采用了 Pulmatrix 公司专有的iSPERSETM技术干粉传递平台(吸入性小颗粒极易吸入和放出) ,可使药物PUR1900达到局部浓度最大化并以此减少全身性不良反应,提高肺部靶向治疗,克服了口服药物生物利用度低的难题,减少了药物间的相互作用。在治疗肺部的囊性纤维化及抗真菌感染方面有很好的治疗前景。Pulmatrix公司出具的临床前数据显示,在体外研究中,PUR1900对烟曲霉菌、病原体引起的囊性纤维化及肺部感染有显著疗效;在大鼠体内PUR1900则表现出肺部的高浓度以及低暴露值,体内药物代谢半衰期较长,具有长期疗效。目前正在对其进行的随机、双盲、安慰剂对照的Ⅱ期临床研究招募患者,以评估Pulmazole对变态反应性支气管肺曲菌病(ABPA)哮喘患者的安全性、耐受性、肺功能和生物标志物反应。为了使读者能对目前吸入制剂的发展趋势及进展有更进一步的了解,表 5 列举了较具代表性产品。
4 吸入制剂研发趋势
4.1 缓释吸入剂将成研发热点
肺吸入给药是除口服、注射给药外另一种更具吸引力的给药途径。从作用时长来看,药物在肺部消除快速,半衰期短。目前关于肺部给药临床研究显示,由于肺部独特的生理特点(较大的血流量与丰富的毛细血管) ,大多需多次给药,患者依从性差。因而需开发能够提高药物疗效、 提高药物使用顺应性的肺部缓释制剂[41]。其可避免肺部巨噬细胞的清除,在肺部驻留数周的纳米制剂(其保证不被呼出的机制是纳米粒团聚至微米级的团聚体后再被吸入)就是非常有潜力的肺部缓释载体[42]。肺部给药纳米载体主要有纳米脂质体、纳米胶束、固体脂质纳米粒、微球、纳米晶、纳米乳等。其中,纳米脂质体是目前研究较多的肺部给药系统。肺泡表面的表面活性物质主要成分是二棕榈酰磷脂酰胆碱的磷脂,而脂质体膜材的主要成分也为磷脂,因此脂质体与肺泡生物相容性好、给药后不易引发毒性反应和免疫反应[43];药物包封于脂质体中不仅能降低药物对肺的刺激、损伤,也能降低对肺黏膜纤毛的毒性和药物的消除速率。近年来,许多药物用脂质体作为肺部给药的缓释载体, Shah等[44]用饱和的大豆磷脂酰甘油和硬脂酰胺制备了 2 种阿米卡星脂质体(AMK1 和 AMK2) ,大鼠肺部吸入阿米卡星脂质体后的有效部位沉积量(FPF)数据结果显示,制备的脂质体具有较好的体内缓释效果。纳米胶束是在水环境中由两亲性嵌段共聚物自组装形成的纳米输送系统,尺寸一般为10~100nm,在肺部缓释的应用主要基于其较小的粒径和亲水性的外壳。胶束较小的粒径可以避免肺巨噬细胞的摄取,因此延长了在肺部的作用时间。亲水性的外壳可减少胶束与单核吞噬细胞系统(mononuclear phagocytic system, MPS ) 间的相互作用,避免被MPS大量摄取。多种两亲性材料可以用于制备聚合物胶束,疏水部分可以由磷脂或疏水性聚合物形成,而亲水外壳常用FDA批准的辅料聚乙二醇( polyethylene glycol,PEG)或聚氧乙烯( polyeth⁃ylene oxide,PEO) 。Gill 等[45]制备了载紫杉醇PEG⁃二硬脂酰磷脂酰乙醇胺胶束,体外释放延长至8h,大鼠肺部给药后进行研究,与聚氧乙烯蓖麻油和乙醇助溶的紫杉醇制剂相比较,具有更好的肺部驻留;固体脂质纳米粒是20世纪90年代初发展起来的新一代亚微粒给药系统,其结合了脂类的生物相容性以及纳米粒子的工业化可能性。目前,如强的松、地西泮已被用于固体脂质纳米粒的肺部给药的应用[46]。体外也有研究结果表明,载药的固体脂质纳米粒可以在5d 至7周内不断释放。作为治疗单核巨噬细胞系统疾病的载体,其在肺部给药系统的应用具有良好的前景;微球是指均匀的球体构成的聚合物基质,已被不同靶向给药方式利用。生物可降解的聚合物纳米微球作为肺部控释给药载体近年来得到了广泛关注。与脂质体相比,微球具有在体内和体外的更稳定物理化学行为,并可以达成缓释效果,具有较好的药理学活性,有利于将药物递送到肺部;纳米混悬剂是一种纯药物纳米颗粒的亚微细粒胶态分散体,以表面活性剂为增溶剂,其可提高靶细胞内的药物浓度、降低全身性药物浓度而减少药物的潜在毒性[47]。
4.2 吸入粉雾剂会成为主流剂型
从剂型研发选择来看,当前传统药物剂型同质化竞争严重,利润大幅下降。近几十年来,吸入粉雾剂不断发展,新的处方及装置设计得以不断应用。有研究机构IQVIA通过分析2013—2019年全球吸入制剂剂型趋势变化得出,在全球各剂型销售金额中,气雾剂占32% ,粉雾剂占46% ,雾化溶液占22% ,粉雾剂的销售金额最大。相信在不久的将来,DPI终将取代MDI,成为治疗呼吸系统疾病的主流剂型。另外,因近年来生物制药及基因工程技术取得了长足发展,出现了大量的多肽和蛋白质类大分子药物。此类大分子药物膜透性差、水溶性强、在胃肠道内易酶解失活、稳定性差、体内半衰期较短,当前大部分都是通过注射给药。而众所周知,粉雾吸入方式可有效增加多肽蛋白质类药物的稳定性,提高其生物利用度。随着对这类大分子药物肺部给药载体及其吸收机制的深入研究[48],粉雾吸入剂必将迎来更为广阔的发展空间。
4.3 通过肺部给药的方式治疗全身系统疾病
从治疗领域来看,多年以来呼吸系统疾病中的COPD和哮喘一直都是吸入剂创新制剂最热门的疾病领域。 而近年来,虽然其应用范围有了一定的扩展,但主要还是集中在肺部局部作用的适应证增加,如肺部囊性纤维化等。对于未来吸入制剂治疗领域的发展,利用嗅区通道使药物直接进入大脑的特点开发中枢神经系统靶向性给药制剂不失为重要的研究方向,例如可用于阿尔茨海默病、戒毒以及减肥等相关疾病的治疗;吸入给药治疗呼吸道肿瘤也是极具发展前景的领域,如常用来作为肿瘤药物的基因/ 核酸药物;吸入给药与静脉给药相比,在呼吸系统疾病治疗方面具有更可靠的疗效,且不良反应更小。另外,有报告指出,众人看来非常小众的麻醉吸入剂市场, 于2013—2018年全球销售额约13亿美元,且目前外科手术越来越多地采用吸入麻醉药来诱导和维持全身麻醉,这将促进行业增长,所以2025年吸入麻醉市场预计将超过19亿美元,2019—2025年的增长率预计将达到5.4% 。所以,吸入性麻醉也极可能成为未来吸入创新制剂的研究热点;当然,开发能获得高达7年市场独占期的罕见病新药肯定也是社会发展方向;随着近几年流感在世界范围内的暴发和流行,特别是2020年新型冠状病毒肺炎疫情的暴发,抗流感药物吸入制剂亦是一个重要研究方向,目 前,已经有研究证明Relenza® (扎那米韦吸入剂)对其有一定的治疗作用,并且也有日本新型冠状病毒肺炎患者在使用哮喘药物(吸入环索奈德药物) 后肺炎症状减轻。
5展望
因其独特的给药途径和优势,吸入给药成为除口服和注射给药的一种非常重要的治疗方法,目前已在全球市场上有了较为广泛的应用。近年来,随着吸入药物市场的扩大和人们对呼吸道及有关生理结构认识的不断加深、不同剂型的不断更新发展、药物作用机制的不断明确,吸入给药系统已取得了长足的发展,很多吸入新药也在积极的研究中,相信在不久的将来,会有更多长效吸入制剂成功上市,造福于世界。

来源:Internet


