您当前的位置:检测资讯 > 热点事件
嘉峪检测网 2022-04-13 05:10
启明医疗的经导管人工肺动脉瓣膜置换(TPVR)系统VenusP-Valve获欧盟CE MDR认证,批准上市销售,成为全球首个获CE MDR认证的心血管器械,也是欧洲第一款获批上市的中国国产创新瓣膜。
中重度肺动脉瓣反流常见于先天性心脏病纠治术后,将导致右心室容量负荷增加,长期可引发心律失常甚至猝死。传统的开胸植入人工肺动脉瓣手术难度大,风险大,死亡率较高。VenusP Valve 正是一款用于治疗伴有或不伴有右心室流出道(RVOT)狭窄的中重度肺动脉瓣反流患者的经导管TPVR产品。
根据弗若斯特沙利文分析,在全球范围内,主要受法洛氏四联症(ToF)及其他RVOTD患者人数增加推动,TPVR合资格患者人数从2014年的62,500人增加到2018年的76,100人,预计到2025年将增加到 127,700人。
但放眼全球,目前仅有4款获批的TPVR产品。除了上述的国产瓣膜VenusP-Valve,另外3款分别为来自海外的Melody, Sapien XT及Harmony。但因这3款瓣膜的可用尺寸较少,导致临床应用受到限制, 仅能解决约15%至20%的患者需求。VenusP-Valve瓣膜尺寸规格多,适用范围广,在临床上可以满足超过 85% 患者的需求。VenusP-Valve获批之前,市场上尚无一款针对不同解剖形态、尺寸规格覆盖范围更广的治疗产品。
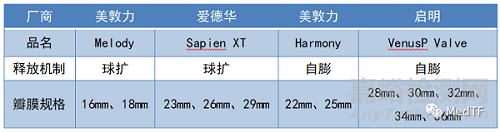
VenusP-Valve
VenusP-Valve是欧洲首个获批上市的自膨胀式TPVR产品,其独特的双喇叭口设计,锚定稳定,释放简便,植入前无需预先放置固定支架。
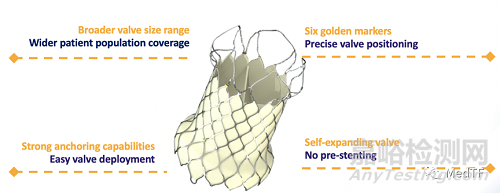
VenusP-Valve瓣膜尺寸规格多,适用范围广
6个黄金显影点,确保瓣膜精准释放
多位锚定设计,锚定稳固
自膨式瓣膜,无需预先放置固定支架
根据欧盟官网公示信息,VenusP-Valve是首个在CE MDR新法规下获批的III类心血管植入类医疗器械。欧盟CE MDR新法规自2021年5月实施,相比旧版MDD法规,大幅提高和细化了技术评审及临床评价等各方面的要求,并新增了临床专家委员会(Expert Panel)审评等程序。此外,新法规对公告机构(NB)的高要求,也让目前获批的能够进行新规公告的机构数量大幅降低。据统计,目前能够进行MDR授权公告的NB机构仅28家,而过去通过MDD授权的公告机构数量超50家。由此可见,CE MDR法规下获批的医疗器械产品“含金量大幅提高”。
VenusP-Valve临床研究
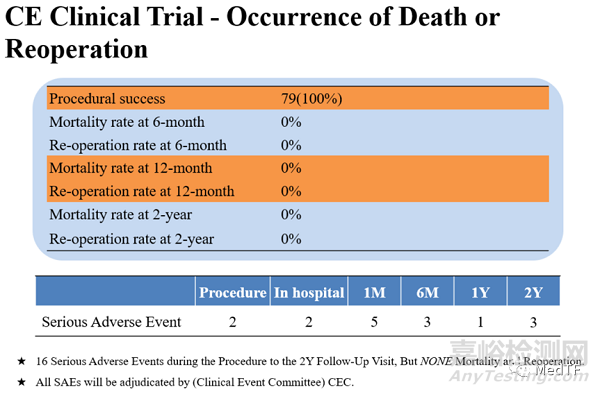
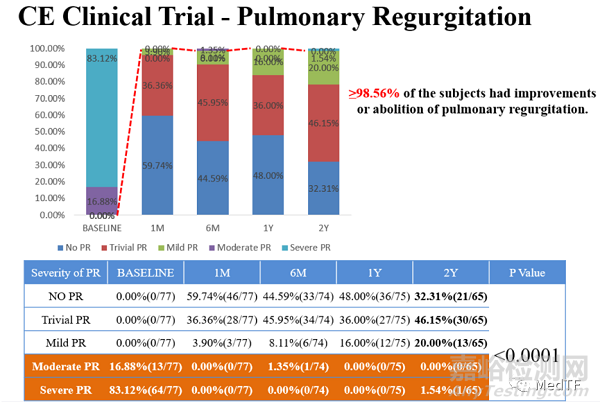
在2021年儿童和成人介入心脏病研讨会(PICS-AICS 2021)上,英国伦敦伊芙琳娜儿童医院的Shakeel Qureshi教授公布了VenusP-Valve的欧洲临床研究2年期结果。数据表明,手术操作成功率达100%,2年后未出现再次手术或死亡。中度肺动脉瓣反流(Pulmonary Regurgitation)从术前16.88%降至0%,重度肺动脉瓣反流从83.12%大幅降至1.54%。

来源:MedTF


