您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2021-12-15 12:38
1 研究背景
2015年2月,美国FDA批准新型复方降糖药物Glyxambi(恩格列净/利格列汀)的上市申请,用于2型糖尿病成年患者的辅助治疗。该药也是目前美国唯一的一款SGLT2抑制剂(恩格列净[empagliflozin],勃林格殷格翰)和DPP-4抑制剂(利格列汀[linagliptin],礼来)的复方药物。
恩格列净利格列汀片含有两种活性成分:恩格列净和利格列汀(Empagliflozin/Linagliptin)。
恩格列净化学结构如下:
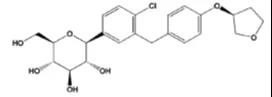
利格列汀化学结构如下:
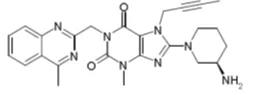
为了解该复方制剂的降解途径,确定处方中的降解产物归属;同时,验证有关物质分析方法的专属性,对该复方制剂进行强制降解试验设计。
2 破坏试验前提
(1)处方工艺初步确定;(2)分析方法专属性和灵敏度初步确定。
3 破坏样品
需要同时对API(恩格列净、利格列汀)、空白辅料、单方制剂(恩格列净+空白辅料;利格列汀+空白辅料;可以按照复方制剂的工艺制备成片剂)和复方制剂(恩格列净利格列汀片)四个层次六个平行进行强制降解试验,其目的为明确归属降解产物的归属途径。
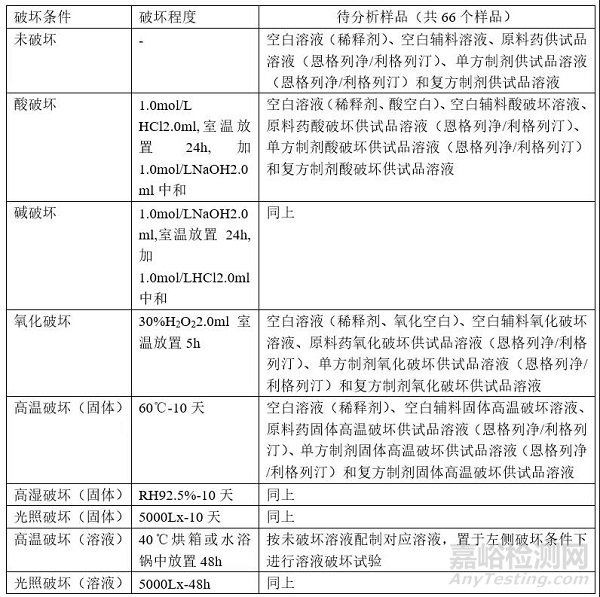
4 破坏条件
破坏条件的设计应考虑药物的生产、储存、流通、使用等。
可采用较强的破坏强度(杂质增加5%-10%),评估方法的检测能力(专属性得经得起考验,杂质能基本覆盖)。
药物在研发、生产、使用过程中,如药物溶出实验、工艺过程、服用过程均可能会接触到酸、碱,故需进行液体的酸、碱破坏;
药物的检测过程,均需配制成溶解状态进行,故需进行溶液状态的高温、光照破坏,为供试品溶液配制方式提供基础数据(是否需要避光、环境温度是否需要控制等);
固体破坏是模拟大部分药物的储存条件,类似于影响因素实验(比加速试验更苛刻,所以也要考虑加速试验或长期试验条件下是否正式存在,如果有,则要重点研究)。
基于以上考虑涉及该复方制剂强制降解破坏条件如下:
上表待分析样品采用相同的前处理条件:
稀释剂为磷酸盐溶液[取无水磷酸二氢钾2.0g,加水1000ml使溶解,并用磷酸调节PH值至2.5±0.1]-乙腈(70:30);
整投法(常规操作为20片至于200ml量瓶,强制降解试验调整为2片至于20ml量瓶);
供试品溶液浓度分别为1mg/ml(恩格列净)、0.5mg/ml(利格列汀);
超声15min,再室温振摇30min;
离心取上清液。
5 试验要求
以未破坏供试品溶液为对照计算破坏样品的活性成分含量;扣除空白溶剂、空白辅料和另一成分及归属杂质后,以面积归一化法计算各活性成分的杂质增加量。
要求:
(1)空白溶剂和各破坏空白辅料色谱图中不得干扰恩格列净、利格列汀及其已知杂质测定;
(2)各降解条件下主成分与相邻杂质峰之间的分离度不得低于1.5;
(3)各降解条件下主成分色谱峰在210~400nm波长范围内纯度因子不得低于980;
(4)物料守恒(恩格列净和利格列汀含量下降值与其杂质增加量的差值)保持在5%以内。
6 试验结果(以酸破坏为例)
(1)典型色谱图
未破坏典型色谱图
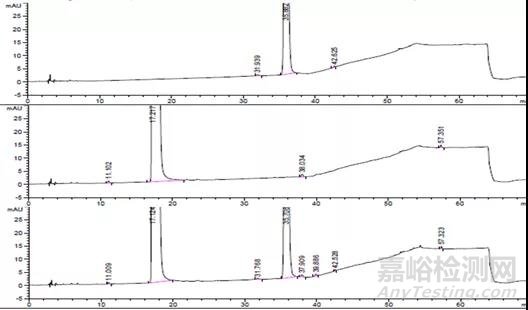
【1】 恩格列净单方制剂未破坏样品;
【2】 利格列汀片单方制剂未破坏样品;
【3】 恩格列净利格列汀复方制剂未破坏样品
酸破坏典型色谱图:
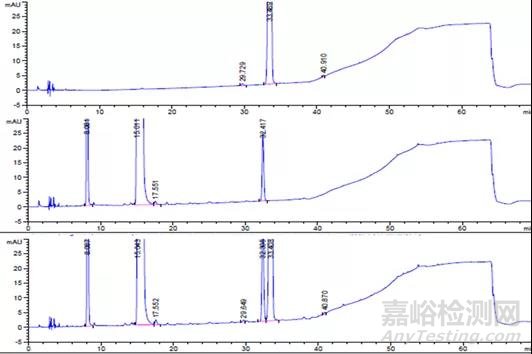
【4】 恩格列净单方制剂酸破坏样品;
【5】 利格列汀片单方制剂酸破坏样品;
【6】 恩格列净利格列汀复方制剂酸破坏样品
(2)主要降解杂质归属
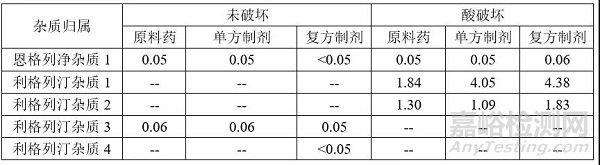
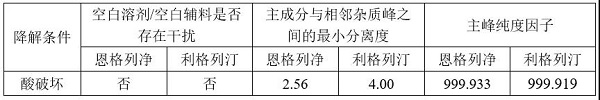
(3)方法专属性考察注:上表复方制剂杂质含量计算方式通过各原料和单方制剂降解杂质归属后扣除另一主成分及另一成分降解杂质后进行面积归一化。
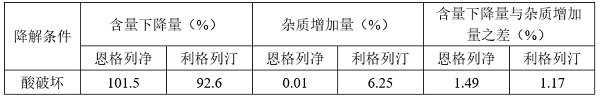
(4)物料守恒(以酸破坏为例)
7 分析与讨论(以酸破坏为例)
① 单一原料药与单方制剂或复方制剂相同破坏条件下产生杂质谱一致,但破坏程度存在差异,制剂降解趋势比原料药明显(不是好消息,说明制剂工艺并未增加活性成分的稳定性;但也可能是个无可奈何的消息,毕竟对于5mg/10mg的有效剂量,不可能直接服用原料药,制剂的意义也要考虑赋型和服用方便);
② 各破坏条件下恩格列净均未产生大于报告限度的杂质,恩格列净性质稳定。因利格列汀在相同破坏条件下,可得到适当的降解杂质,故暂未设计针对恩格列净的复合破坏条件;
③ 酸破坏条件下复方制剂中利格列汀可得到适当的降解杂质,在此条件下可降解杂质达到6%,可作为本方法专属性考察的主要强制降解条件;
④ 酸破坏条件下杂质增加值与含量下降值差值不大于5.0%,满足物料守恒要求,恩格列净与相邻杂质峰之间分离度均大于1.5,且DAD检测器扫描各强制降解溶液的峰纯度均大于990;
⑤ 复方制剂利格列汀酸条件下的主要降解杂质,在加速长期稳定性试验中均未检出,故仅作为未知杂质进行研究(但作为口服固体制剂,考虑胃生理环境,仍建议进行杂质结构鉴定,并对其进行安全性评价)。
结论:在酸破坏条件下,复方制剂中的活性成分恩格列净性质稳定,未发生明显变化;利格列汀可产生明显降解。有关物质分析方法在酸破坏条件下能满足质量守恒的要求,主峰与相邻峰之间分离度满足要求,且峰纯度均不低于980,显示出良好的专属性。

来源:药事纵横


