您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2021-08-30 11:09
更多医药技术资讯,请点击医药专栏:http://drug.anytesting.com/ 欢迎关注文末微信公众号:药研检测drugtest
今日头条
健康元新冠疫苗上国际Ⅲ期临床。健康元旗下丽珠单抗与中国科学院生物物理研究所合作研发的重组新冠病毒融合蛋白疫苗(V-01),在菲律宾开展的国际Ⅲ期临床完成首例受试者入组。据LSHTM跟踪器信息,截至2021年8月2日,全球共有103款新冠疫苗产品处于临床阶段,其中有19款产品已获批上市或紧急使用授权。国内获有条件批准上市共4款,获得紧急使用批准3款,16款处在临床开发阶段(重组蛋白技术路线6款)。
国内药讯
1.氟维司群与阿贝西利联合疗法获批上市。NMPA批准阿斯利康雌激素受体拮抗剂氟维司群注射液(fulvestrant)与CDK4/6抑制剂阿贝西利联用,治疗HR+、HER2-局部晚期或转移性乳腺癌。在一项Ⅲ期MONARCH 2研究中,阿贝西利联合氟维司群显著提高患者的无进展生存期(PFS)(中位PFS:16.4个月vs9.3个月);显著改善患者的总生存期(OS)(中位OS:46.7个月vs37.3个月)。
2.智飞重组新冠疫苗保护率达81.76%。智飞生物旗下智飞龙科马与中科院微生物研究所合作研发的重组新冠病毒疫苗(CHO细胞),在我国湖南省、乌兹别克斯坦等国开展的国际Ⅲ期临床获积极结果。结果显示,该疫苗安全性良好,总体保护效力为81.76%,达到WHO要求的新冠疫苗有效性标准。其中对Alpha变异株的保护效力为92.93%;对Delta变异株的保护效力为77.54%。对预防新冠相关住院和死亡的有效率为100%。
3.荣昌HER2-ADC新NDA拟纳入优先审评。荣昌生物HER2-ADC新药注射用维迪西妥单抗的新适应症上市申请获CDE拟纳入优先审评,用于既往接受过系统化疗且HER2过表达的局部晚期或转移性尿路上皮癌(UC)患者。在临床研究中,维迪西妥单抗治疗的客观有效率达到50%,中位生存时间为14.2个月,中位无进展生存时间为5.1个月。2020年9月,FDA授予该新药用于二线治疗尿路上皮癌的突破性疗法认定。
4.赛生GD2抗体新药拟纳入优先审评。赛生药业那昔妥单抗注射液上市申请获CDE拟纳入优先审评,用于治疗复发性或难治性高危神经母细胞瘤。那昔妥单抗是Y-mAbs公司开发的一款GD2单抗,FDA已于去年11月加速批准那昔妥单抗上市,与GM-CSF联用,治疗复发/难治性高危神经母细胞瘤儿童(1岁及以上)和成人患者。赛生药业拥有该新药大中华地区的开发和商业化权利。
5.信达将布局开发ISAC候选药物。信达生物与Bolt Biotherapeutics将共同开发三款治疗癌症的抗体-免疫刺激偶联物(ISAC)候选药物。根据协议,信达生物将拥有三个合作项目的大中华区权益,同时保留其中一个项目的全球权益、另一项目除北美外区域权益的选择权;信达生物将承担至临床概念验证(POC)期间的所有研发费用。Bolt将获500万美元的首付款,最高可达1000万美元的股权投资,以及潜在里程碑付款和特许权使用费。
6.百奥泰乌司奴单抗海外授权。百奥泰宣布与Hikma Pharmaceuticals签署授权许可协议,将乌司奴单抗生物类似药BAT2206注射液在美国的商业化权益授予Hikma公司。目前,BAT2206正在全球III期临床中评估用于治疗斑块状银屑病的潜力。百奥泰将获2000万美元首付款、累计不超过1.3亿美元里程碑付款和商业特许权使用费,以及销售分成。
国际药讯
1.首款软骨发育不全疗法获欧盟批准。欧盟委员会批准BioMarin公司C型利钠肽(CNP)类似物Voxzogo(vosoritide)上市,用于治疗从2岁开始、直至生长板闭合的软骨发育不全儿童患者。在Ⅲ期临床中,vosoritide可有效促进这类儿童的骨骼生长,而且注射一年后仍然有效。Voxzogo是欧盟批准治疗这一疾病的首款疗法。在美国,FDA正在审评vosoritide的新药申请,PDUFA日期为今年11月20日。
2.达格列净获日本批准治疗慢性肾病。日本厚生劳动省批准阿斯利康达格列净(Farxiga)用于治疗伴或不伴2型糖尿病(T2D)的慢性肾病(CKD)成人患者。Forxiga 也是日本获批用于这类患者的首个治疗药物。在一项III期DAPA-CKD试验中,与安慰剂联合标准治疗相比,Forxiga+标准治疗可使患者心血管或肾脏死亡的风险降低39%,绝对风险降低为5.3%。Farxiga用于相同适应症也于8月初获欧盟委员会(EC)批准。
3.囊性纤维化三联疗法Ⅲ期结果发布。Vertex公司在《新英格兰医学杂志》上发表三联疗法Trikafta(elexacaftor+tezacaftor+ivacaftor)治疗年龄≥12岁、且CFTR基因上至少出现一个F508del突变的囊性纤维化(CF)患者的Ⅲ期临床积极结果。试验结果表明:Trikafta使患者1秒用力呼气容积的预测百分比较基线改善3.7个百分点(95% CI,2.8~4.6;P<0.001),相比活性对照组提高3.5个百分点(95% CI,P<0.001);汗液氯化物浓度较基线改善22.3mmol/L(95% CI,P<0.001),与活性对照相比改善23.1mmol/L(95% CI,P<0.001);安全性数据与已知研究一致。
4.新型CD/LD缓释胶囊Ⅲ期临床积极。Amneal公司新型卡比多巴/左旋多巴(CD/LD)缓释胶囊制剂IPX-203用于帕金森病(PD)患者改善运动症状的关键性Ⅲ期临床RISE-PD获积极结果。与活性对照组相比,IPX-203治疗组第13周患者的症状改善较基线的变化具统计学意义,该组患者的“Good On”时间比活性对照组多0.53小时(p=0.0194)。Amneal计划明年年中向FDA提交新药申请(NDA)。
5.代谢障碍罕见病新疗法Ⅲ期临床积极。阿斯利康口服靶向去铜疗法ALXN1840,在治疗肝豆状核变性(WD)患者的关键性Ⅲ期临床FoCus中达到主要终点。WD是一种罕见的进行性遗传性铜代谢障碍性疾病。与标准治疗(SoC)相比,ALXN1840治疗使患者每日平均组织铜动员(copper mobilization)表现出具有统计学显著性的改善。详细数据将在医学会议上展示。
6.恩格列净治疗HFpEF的Ⅲ期临床积极。勃林格殷格翰与礼来联合开发的SGLT2抑制剂恩格列净(Jardiance),在治疗射血分数保留型心力衰竭(HFpEF)患者的的Ⅲ期临床EMPEROR-Preserved中达复合主要终点,将患者心血管死亡或因心力衰竭住院的相对风险降低21%;并使疾病首次复发和住院的相对风险降低27%;而且安全性数据与既往结果一致。相关结果已在ESC2021大会上公布。FDA本月初已批准该药扩展适应症,用于治疗射血分数降低型心力衰竭(HFrEF)成人患者。
医药热点
1.瑞丽市离市人员健康码将变黄码。云南瑞丽市疫情防控工作指挥部日前发布通告称,为阻断传播扩散渠道,将离瑞人员“健康码”调整为黄码。通告中提到,离瑞审批表审批通过后当天须离瑞,并于次日24时前抵达目的地,中途不得变更行程;离瑞次日24时离瑞人员“健康码”将被转为黄码;黄码人员需居家健康监测7天;在核酸检测显示阴性结果后,“健康码”将自动变为绿码。
2.公立医院薪酬制度改革指导意见发表。国家卫健委等五部门印发《关于深化公立医院薪酬制度改革的指导意见》,共包括七方面内容。在充分落实医院内部分配自主权方面,文件提出,在核定的薪酬总量内,公立医院可采取多种方式自主分配。可结合本单位实际,自主确定更加有效的分配模式。可自主设立体现医疗行业特点、劳动特点和岗位价值的薪酬项目,充分发挥各项目的保障和激励作用。
3.詹启敏院士担任苏州医学院院长。28日,苏州大学印发通知,宣布聘任詹启敏同志为苏州大学苏州医学院院长。詹启敏,男,汉族,曾任中国医学科学院副院长,北京协和医学院副校长,北京大学党委常委、副校长、医学部主任,北京大学深圳研究生院院长。2002年1月至今任中国医学科学院分子肿瘤学国家重点实验室主任。
评审动态
申请临床:
祐和医药的YH001注射液、上海君实的UBP1213sc注射液、四川三叶草的阿柏西普眼内注射溶液、勤浩医药的GH21胶囊(个规格)、中南民族大学的乳藤胶囊、南京维立志博的LBL-007注射液、石药集团中奇制药的重组抗PD-1全人源单克隆抗体注射液、北京双鹭的长效重组人胰高血糖素样肽-1注射液(2个规格)、优时比的Rozanolixizumab注射液、和铂医药的HBM9161(HL161BKN)注射液。
申请生产:
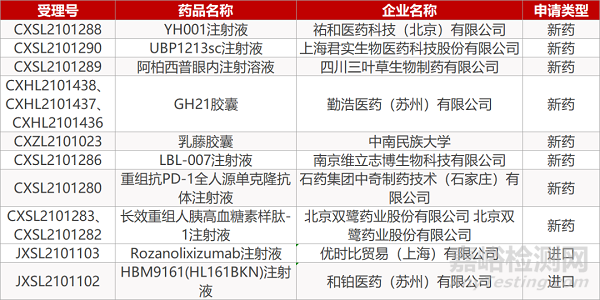

来源:药研发


