您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2021-08-11 17:08
【摘要】目的 通过比较盐酸乙胺丁醇片在四种介质中的溶出行为,获得具有区分力的溶出曲线,并以此为依据,筛选出溶出曲线与参比制剂最为相近的制备工艺。方法 建立具有区分力的溶出曲线测定方法,以该溶出条件考察不同制备工艺自制制剂的溶出行为,采用相似因子(f2)法与参比制剂比较溶出曲线,得到最相近的制备工艺。结果 溶出曲线方法采用桨法,溶出介质为水介质,体积为900 ml,转速为50 r/min,HPLC 法检测;湿法制粒法和流化床制粒法的制备工艺对应的f2 因子分别为31.1、60.4,表明流化床制粒法与参比制剂制备工艺最为相似。结论 具有区分力的溶出曲线可用于盐酸乙胺丁醇片制备工艺的筛选;两种制备工艺所得片剂溶出行为具有显著差异;流化床制粒法所得片剂与参比制剂体外溶出行为最相似。
乙胺丁醇作为一线抗结核药品,常与利福平、异烟肼、吡嗪酰胺合用治疗各种肺结核及肺外结核,被认为是安全有效、不良反应发生率较低的重要药物[1]。鉴于全球还有很多人感染结核病,当今结核病仍未有效控制,世界范围内对抗结核药的需求仍然巨大,因此有必要开展盐酸乙胺丁醇片仿制制剂与参比制剂的一致性评价研究,提高仿制制剂的质量。而采用有区分力的溶出曲线来剖析仿制制剂的内在质量,是用于评估仿制制剂处方工艺、获得参比制剂关键特征以及提高生物等效性试验通过率的重要手段之一[2]。本研究采用了日本上市的Ebutol ® Tablets 250 mg 作为参比制剂[3],以具有区分力的溶出曲线为依据,筛选出与参比制剂最为相近的制备工艺,为仿制制剂放大生产工艺的确定提供参考,并为提高生物等效性试验的通过率提供依据。
1 仪器与材料
1.1 仪器
GH-200 型电子分析天平(日本AND 公司);FADT-1202自动溶出试验仪(上海富科思分析仪器有限公司);紫外分光光度计(北京普析通用仪器有限责任公司);高效液相色谱仪Agilent 1260[ 安捷伦科技(中国)有限公司]。
1.2 材料
盐酸乙胺丁醇片(规格:250 mg,广州白云山明兴制药有限公司);盐酸乙胺丁醇片参比制剂(规格:250 mg,日本科研株式会社);盐酸乙胺丁醇对照品(中国食品药品检定研究院);氯化钠、醋酸钠、磷酸二氢钾、十二水合磷酸氢二钠、盐酸、冰醋酸、磷酸、氢氧化钠、醋酸铵、醋酸铜均为分析纯,甲醇为色谱纯,水为纯化水。
2 方法与结果
2.1 自制制剂的制备
采用相同的制剂处方,以湿法制粒工艺和流化床制粒工艺制备盐酸乙胺丁醇片的自制制剂,两种工艺的过程描述如下。
2.1.1 湿法制粒工艺
采用湿法制粒压片技术,步骤如下:①过筛:将原料药和辅料分别过筛备用;②混合:将原辅料置于湿法制粒机中混合均匀;③制粒:将粘合剂喷入上步混合均匀的粉末中制软材,12 目筛湿整粒;④干燥:将所制颗粒加入流化床,干燥至水分合格;⑤总混、压片:加入处方量的硬脂酸镁混合均匀后压片;⑥包衣:将薄膜包衣预混剂加入水中搅拌成均匀状态的混悬液,包衣即得。
2.1.2 流化床制粒工艺
采用流化床一步制粒技术,步骤如下:①过筛:将原料药和辅料分别过筛备用;②制粒、干燥:将喷枪安装于适宜高度喷孔,设定适宜的雾化压力、进风风量、进风温度,喷入粘合剂溶液,控制流速进行制粒,制粒结束后直接进行干燥,并干燥至水分合格;③整粒:30 目筛整粒;④总混、压片:加入处方量的硬脂酸镁混合均匀后压片;⑤包衣:将薄膜包衣预混剂加入水中搅拌成均匀状态的混悬液,包衣即得。
2.2 溶出曲线分析方法的建立
由于选用日本科研株式会社的盐酸乙胺丁醇片作为参比制剂,自制制剂的多介质溶出曲线分析方法基于日本橙皮书进行开发,同时参考中国药典ChP2020 盐酸乙胺丁醇片的溶出度分析方法,建立溶出曲线分析方法。
2.2.1 溶解性
参照中国药典ChP2020,通过摇瓶法测定利盐酸乙胺丁醇在pH1.2 盐酸溶液、pH4.0 醋酸盐缓冲液、pH6.8 磷酸盐缓冲液和纯化水中的饱和溶解度[4]。结果盐酸乙胺丁醇在4 种溶出介质中饱和溶解度分别为836.2 mg/ml、835.3 mg/ml、845.9 mg/ml、841.0 g/ml,溶解性良好且溶解度受pH 值影响不大。
2.2.2 溶出曲线试验方法
选择pH1.2 盐酸盐溶液、pH4.0 醋酸盐缓冲液、pH6.8 磷酸盐缓冲液和纯化水作为四种溶出介质,溶出条件为桨法,50 r/mim,溶出介质体积为900 ml,取样时间点为10、20、30 min。
2.2.3 溶出曲线定量方法
检测方法为高效液相色谱法(HPLC),色谱条件如下:色谱柱:Agilent ZORBAX SB-C18(4.6 mm×250 mm,5μm);流动相:醋酸铵/ 醋酸铜溶液- 甲醇= 88∶12(V/V);流速:1.0 ml/min;柱温:40℃ ;进样量:10 μl;检测波长:270 nm。
2.3 方法验证
2.3.1 专属性试验
取供试品溶液、对照品溶液、空白辅料溶液及四种溶出介质分别按2.2.3 项下的色谱条件进样。结果显示,在四种溶出介质条件下,溶出介质和空白辅料在乙胺丁醇出峰处不出峰,无干扰,样品溶液的主峰保留时间与对照品溶液一致,该方法专属性良好。
2.3.2 线性范围
精密称取盐酸乙胺丁醇对照品约70 mg,置100 ml 容量瓶中,加纯化水稀释制成约700 μg/ml 对照品储备溶液。精密量取盐酸乙胺丁醇对照品储备液1、2、2、10、5 ml 分别置于25、25、10、25、10 ml 量瓶,作为线性10%、20%、50%、100%、125% 水平溶液,分别进样检测,以峰面积对浓度进行线性回归。4 种介质平行操作,结果见表1。

结果显示,4 种溶出介质条件下,盐酸乙胺丁醇在10% ~ 125%样品浓度范围内,线性相关系数的平方r 2 均为1.000(> 0.995),线性结果符合可接受标准。
2.3.3 准确度
精密称取空白辅料适量置于不同1 000 ml 量瓶,分别加入约27.8、278 及347.5 mg 盐酸乙胺丁醇原料药,用溶出介质定容至刻度,每个浓度平行操作3 份,分别配制成高、中、低3 个水平的回收率溶液,过滤,取续滤液作为供试品溶液,按2.2.3项下的色谱条件进样测定。4 种介质平行操作,10% 准确度溶液的回收率为91.7% ~ 100.2%(在80.0% ~ 120.0% 之间);RSD 为0.5% ~ 3.2%(< 20%);100% ~ 125% 准确度溶液的回收率为99.7% ~ 101.8%(在95.0% ~ 105.0% 之间);RSD 为0.1% ~ 0.5%(< 5%);9 份样品溶液回收率的RSD为0.5% ~ 3.2%(< 15%)。盐酸乙胺丁醇各浓度的回收率和RSD 结果符合可接受标准,说明该方法准确度良好。
2.3.4 重复性及中间精密度
取自制制剂6 片,按照“2.2.2”项下的溶出试验方法,在10、20、30 min 时取样测定;另取同批号的自制制剂6 片,由不同分析员,在不同的日期采用不同的仪器同法取样测定。4 种介质平行操作,不同分析人员在10 min 和20 min 取样时间点平行6 份样品溶液的溶出度平均值为37% ~ 75%(< 85%),差值为1% ~ 2%(< 10%);在30 min 取样时间点平行6 份样品溶液的溶出度平均值为88% ~ 95%(> 85%),差值为1% ~ 4%(< 5%)。不同分析人员各自在10 min 时6 份样品的RSD 为6.3% ~ 10.5%(< 20%),12 份样品的RSD 为7.9% ~ 9.6%(< 20%);在20 min和30 min 时6 份样品的RSD 为4.0% ~ 9.8%(< 15%),12 份样品的RSD 为4.9% ~ 8.5%(< 15%)。结果表明,该试验方法的重复性及中间精密度良好。
2.3.5 溶液稳定性
取“2.3.4”项下的对照品溶液及任一杯样品溶液,分别于2℃~8℃冰箱和室温放置2 d 后进行测定。结果显示,在4 种介质中,在2℃~8℃冰箱和室温条件下贮存2 d 的对照品溶液与0 d 相比,回收率为98.0%~101.1%(在98.0%~102.0%之间);在2℃~8℃冰箱和室温条件下贮存2 d 的样品溶液与0 d 相比,回收率为98.0%~101.9%(在98.0%~102.0% 之间),说明对照品和样品在四种介质中稳定性良好。
2.4 采用有区分力的溶出曲线筛选制备工艺
以“2.1”项下所述的两种工艺制备盐酸乙胺丁醇片,以日本科研株式会社的市售产品(批号:L69680)作为参比制剂,以“2.2”项下的溶出曲线试验方法对制备工艺进行筛选。参照《普通口服固体制剂溶出曲线测定与比较指导原则》[5] 的溶出曲线相似性比较要求,当仿制制剂与参比制剂在15 min 的平均溶出度< 85%,则进行相似因子f2 的比较,若相似因子f2 ≥ 50,可认为两者溶出曲线相似。即制备工艺以所得溶出曲线与参比制剂相似者,且f2 因子数值最大者为佳。
2.4.1 参比制剂多介质溶出曲线
取日本科研株式会社的市售产品按“2.2”项下的方法进行溶出曲线的考察,在四种溶出介质中溶出曲线比较见图1。
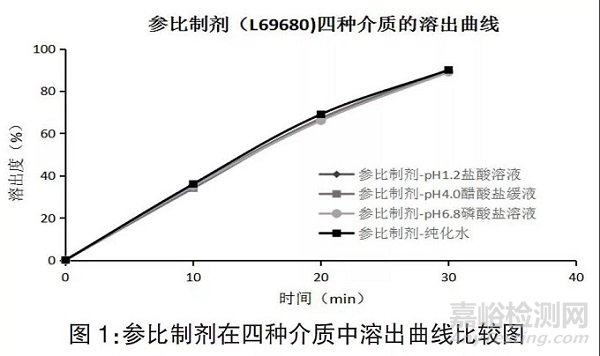
结果显示,参比制剂在4 个介质中溶出行为差异不大,而纯化水较其他3 个介质更环保、方便易得,因此选取纯化水作为筛选不同制备工艺的区分介质。
2.4.2 不同制备工艺的自制制剂与参比制剂的溶出曲线比较
取湿法制粒工艺自制制剂、流化床制粒工艺自制制剂按“2.2”项下的方法进行溶出曲线的考察,在纯化水中溶出曲线与参比制剂相比所得的f2 因子结果见表2,溶出曲线比较图见图2。

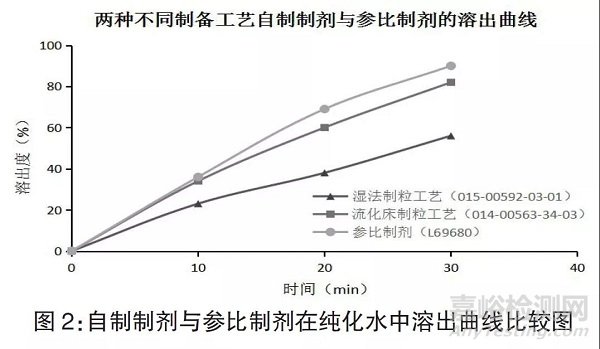
由两种不同制备工艺所得的自制制剂与参比制剂的f2 因子的结果(表2)可知,采用流化床制粒工艺所得片剂在水介质溶出f2 值> 50,溶出行为与参比制剂相似,具有较好的工艺可行性,据此判断采用流化床制粒工艺为较佳处方。
2.4.3 流化床制粒工艺制备的自制制剂在四种介质中的溶出曲线考察
采用流化床一步制粒的工艺制备1 批自制制剂(022-00592-22)与参比制剂(L69680),按“2.2”项下的方法,考察自制制剂与参比制剂在四种不同介质下的溶出行为。溶出结果见图3。结果表明,自制制剂在四种介质中溶出与参比制剂f2 相似值均> 60,具有溶出一致性,流化床一步制粒工艺可筛选为盐酸乙胺丁醇片的制备工艺。
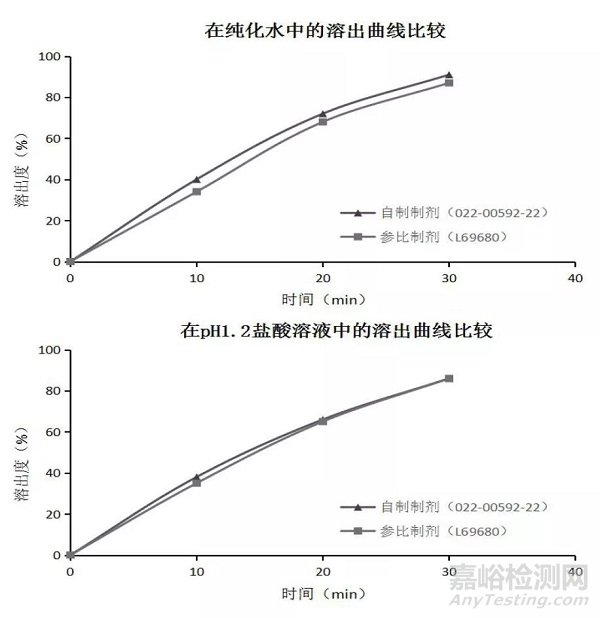
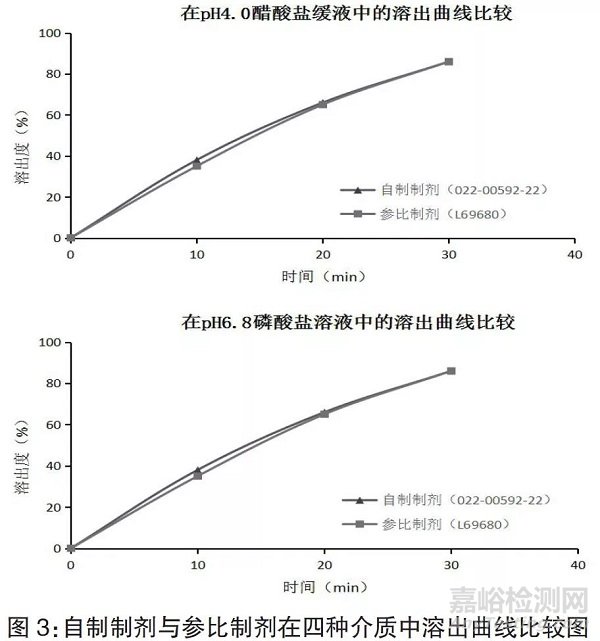
3 讨论
3.1 溶出曲线检测方法的选择
日本橙皮书采用UV 法,供试品溶液需采用二氯甲烷萃取,操作繁琐,分析效率低。ChP2020 采用HPLC 法,与含量方法一致,而且HPLC 法专属性好,准确度高,自动化高,故以ChP2020盐酸乙胺丁醇片含量分析方法的色谱条件为基础,开发并优化溶出曲线样品的检测方法。
3.2 结论
在口服固体制剂品质评价和仿制药一致性评价中,最为有效的手段就是建立能体现参比制剂内在质量、具有区分力的溶出曲线。在固体制剂制备工艺中,制粒技术是最关键的技术之一。制粒过程中所得颗粒的粒径大小或密度高低,都会影响可压性,最终影响产品的溶出行为[5]。
本文建立具有区分力的溶出曲线试验方法,对不同的制粒制备工艺进行了筛选,通过自制制剂与参比制剂的多条有区分力的溶出曲线相似,确定采用流化床一步制粒工艺制备盐酸乙胺丁醇片。


来源:Internet


