您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2021-07-28 10:48
更多医药技术资讯,请点击医药专栏:http://drug.anytesting.com/ 欢迎关注文末微信公众号:药研检测drugtest
今日头条
国内药讯
1.泽布替尼在加拿大获批新适应症。加拿大卫生部批准百济神州BTK抑制剂百悦泽®(泽布替尼)用于治疗经治的成人套细胞淋巴瘤(MCL)患者。这是百悦泽®继华氏巨球蛋白血症之后,在加拿大取得的第二项适应症批准。在一项Ⅱ期临床BGB-3111-206(NCT03206970)中,中位随访时间为18.5个月时,百悦泽®在MCL患者中的ORR达到84%(95% CI: 74, 91);中位缓解持续时间(DoR)达到19.5个月(95% CI: 16.6, 不可估计[NE])。
2.科兴新冠疫苗加强针临床数据积极。科兴新冠疫苗克尔来福用于18-59岁健康成年人接种第三剂的Ⅱ期临床中期结果公布。研究结果显示,接种两剂疫苗后可产生良好的免疫记忆,在接种第二剂后的第28天至6个月接种第三剂后,中和抗体水平显著高于基线水平,接种第三剂后28天中和抗体滴度比第二剂后28天中和抗体滴度增加了3-5倍;不良事件均为1级或2级,未出现相关的严重不良反应。
3.信达PD-1/TIGIT双抗上Ⅰa期临床。信达生物与礼来制药联合开发的PD-1/TIGIT双特异性抗体IBI321,在治疗晚期恶性肿瘤的Ⅰa期临床中完成首例患者给药。这是一项开放标签、多中心、剂量递增、包含扩展研究的Ⅰa期试验,将在接受标准治疗中发生癌症进展的晚期实体瘤患者中,评估IBI321的安全性、耐受性、潜在最佳剂量和初步疗效。临床前研究结果显示,IBI321保留PD-1抑制剂的药效活性并同时抑制TIGIT的信号,协同增强药效。
4.君实EGFR靶向新药上临床。君实生物EGFR非常见突变抑制剂AP-L1898胶囊(JS111)在I/II期临床中完成首例患者给药。该研究将评估JS111治疗局部晚期或转移性非小细胞肺癌患者的安全性、耐受性、药代动力学特征及初步疗效的剂量递增、剂量扩展和疗效拓展研究。在临床前研究中,JS111保持了抑制T790M等EGFR常见变异的活性和对野生型EGFR的选择性,而且还克服了第三代EGFR抑制剂对exon 20插入等EGFR非常见突变的不敏感。
5.诺诚健华与合全药业达成战略合作。诺诚健华与药明康德子公司合全药业达成战略合作,将携手加快诺诚健华恶性肿瘤及自身免疫性疾病治疗领域1类新药的开发进程。根据协议,合全药业将成为诺诚健华首选CDMO合作伙伴,为诺诚健华在研及后续管线产品(包括小分子药物、多肽、寡核苷酸、复杂化学偶联药物等)提供原料药研发及委托生产服务,包括但不限于原料药的工艺开发、生产、分析,以及支持新药申报的注册文件准备等。
国际药讯
1.GSK带状疱疹疫苗获扩大使用范围。FDA批准葛兰素史克带状疱疹疫苗Shingrix(欣安立适)用于在18岁及以上免疫功能低下的成人中预防带状疱疹。Shingrix是一种重组亚单位佐剂疫苗,分两剂肌肉注射。该产品此前已获FDA批准用于50岁及以上成人预防带状疱疹,此次对18岁及以上免疫功能低下人群的批准,扩大了可通过Shingrix预防带状疱疹的人群。在中国,欣安立适已于2020年6月获得批准,用于50岁及以上成人预防带状疱疹。
2.A型血友病基因疗法Ⅲ期临床积极。BioMarin制药公司公布AAV基因疗法valoctocogene roxaparvovec(valrox,BMN270)单次输注治疗重度A型血友病Ⅲ期GENEr8-1研究最新积极数据。一年或更长时间的随访数据显示,超过90%的患者年化出血率(ABR)为零、或在接受valrox治疗第4周后低于基线水平。在一项非干预性基线观察研究中预先指定的一组既往患者中,valrox治疗第4周后,平均年化因子VIII利用率与基线水平相比下降99%,从基线水平3961.2(中位数:3754.4)下降至56.9(中位数:0)IU/kg/年(p值<0.001)。
3.mTOR抑制剂获FDA优先审评资格。Aadi Bioscience公司西罗莫司白蛋白结合型纳米颗粒Fyarro(ABI-009)的新药申请(NDA)获FDA授予优先审评资格,用于治疗晚期恶性血管周围上皮样细胞瘤(PEComa)。PDUFA日期为2021年11月26日。ABI-009(sirolimus)是一种特异性mTOR抑制剂,该新药此前已获FDA授予孤儿药资格、快速通道资格和突破性疗法认定。亿腾景昂公司拥有该药在大中华区的独家开发和商业化权利。
4.AAV基因疗法最新临床结果积极。Abeona Therapeutics公司新型基因疗法ABO-102在治疗A型Sanfilippo综合征(MPS IIIA,也称为粘多糖贮积病IIIA型)儿科患者的Ⅰ/Ⅱ期Transpher A临床中获积极结果。核磁共振成像(MRI)的数据表明,在第24个月时,与未经治疗的患者相比,ABO-102显著增加了3例患者大脑中的脑灰质、胼胝体和杏仁核体积。ABO-102耐受性良好,在治疗后15-45个月的观察期内仍具有长期安全性,没有出现与治疗有关的严重不良事件。
5.第二代STING激动剂早期临床积极。F-star公司第二代STING激动剂SB 11285在治疗晚期实体瘤患者的Ⅰ期临床中获积极中期结果。该研究评估静脉输注的SB 11285作为单药或与PD-L1单抗atezolizumab联用的安全性和疗效。中期结果显示,SB 11285单药的5种剂量均表现出良好的耐受性;与atezolizumab联用的3个剂量组也表现出良好的耐受性;而且初步药代动力学分析结果与SB 11285能够被细胞快速吸收相一致。
6.BMS撤回Opdivo用于肝细胞癌上市资格。在与FDA协商后,百时美施贵宝日前宣布撤回PD-1抑制剂Opdivo (nivolumab)在美国市场单药用于此前接受过索拉非尼(sorafenib)治疗的肝细胞癌(HCC)患者适应症。此前,FDA基于一项I/II期临床CheckMate-040研究肿瘤缓解数据加速批准Opdivo用于上述适应症。然而在确证性临床试验CheckMate-459中,Opdivo与索拉非尼头对头一线治疗肝细胞癌患者没有达到总生存期的主要终点。
医药热点
1.上海推广老年综合评估服务。上海市卫健委日前印发《便利老年人就医实施方案》,部署建立预检专属通道、提供多渠道挂号服务、优化线上线下服务流程、建立便利的配药服务、开展老年综合评估服务、推行医务社工及志愿者服务、构建适老化就医环境7个方面的重点任务。《方案》要求二级以上综合性医院要在老年医学科或内科门诊开展老年综合评估服务,对老年患者高风险因素给予早期识别与干预,保障医疗安全。
2.全国普通门诊费用跨省直接结算进展。国务院日前在政策例行吹风会上介绍我国优化医保领域便民服务有关情况。截至目前,全国已有315个统筹地区开通普通门诊费用跨省直接结算,覆盖全国70%的统筹地区;其中北京、天津、河北等18个省份和新疆生产建设兵团已实现区域内所有统筹地区全覆盖。2021年1至6月份,全国门诊费用跨省直接结算约339万人次,涉及医疗费用8.48亿元,基金支付4.65亿元。
审评动向
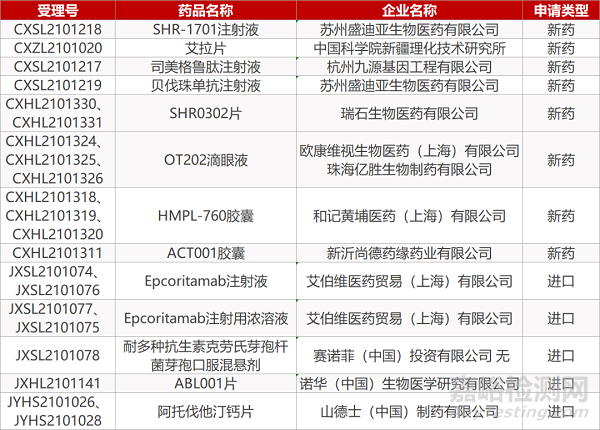
苏州盛迪亚的SHR-1701注射液、中国科学院新疆理化的艾拉片、杭州九源基因的司美格鲁肽注射液、苏州盛迪亚贝伐珠单抗注射液、瑞石生物的SHR0302片(2个规格)、欧康维视/ 珠海亿胜的OT202滴眼液(3个规格)、和记黄埔的HMPL-760胶囊(3个规格)、新沂尚德药缘的ACT001胶囊、艾伯维的Epcoritamab注射液(2个规格)和Epcoritamab注射用浓溶液(2个规格)、 赛诺菲的耐多种抗生素克劳氏芽孢杆菌芽孢口服混悬剂、诺华的ABL001片。

来源:药研发


