您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2021-07-05 19:28
药物的溶解度是影响口服固体制剂吸收的重要因素。我们都知道,固体口服制剂只有药物先溶解,才可以进行后续的吸收。而药物溶解性差会产生不良的ADME过程,会导致口服生物利用度低、化学稳定性差、处方优化困难等问题。
药物的水溶性和肠膜渗透性是影响药物吸收的关键参数。以这些参数为基础,将药物分为四类,如下图所示:
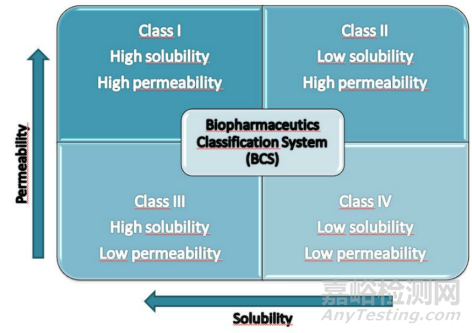
图1. BCS分类
具有良好理化性质的药物属于I类,它们有足够的溶解性和渗透性,可以从胃肠道很好地吸收。总体而言,这类药物具有良好的口服生物利用度。
II类药物溶解性较差,但渗透性较好。因此,此类药物在胃肠道中的溶解是限制其吸收的因素。
第Ⅲ类药物具有良好溶解性,但渗透性较差,造成这种情况的原因是药物的亲水性太强,脂溶性较差,所以渗透性较差。通常情况下,这类药物是适合通过注射进行给药。
IV类药物在水中的溶解度很低,而且很难从胃肠道吸收。因此,此类药物的口服生物利用度很差,IV类药物也是相对较难开发的药物。
由于目前我们开发的药物大多数都是亲脂性的,因此往往水溶性都是较差的。这可能导致药物的吸收不完全,从而降低了口服药物的生物利用度。为了克服这一障碍,人们开发了许多增加药物溶解度的方法,下面我们一起来学习一下这些药物增溶的技术手段。
目前药物增溶技术具有多种,如修饰药物的化学结构、减小药物粒径、固体分散体技术、环糊精包合物、自乳化给药系统等。药物增溶技术分类如图2所示。
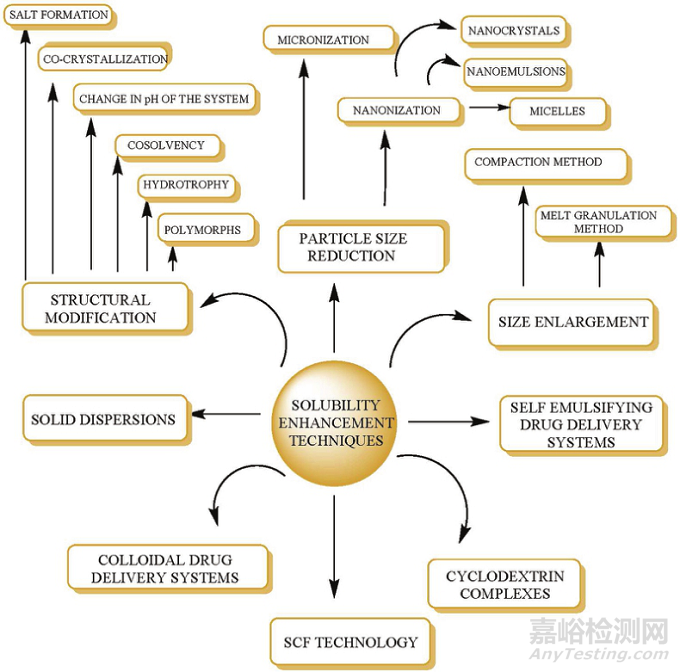
图2. 药物增溶技术
1、固体分散体
固体分散体类型
固体分散体是指药物与载体材料形成的无定形或者晶体状态的分子分散系统。固体分散体可简单的分为低共熔混合物、固体溶液、无定形共沉淀物以及玻璃溶液四类。
低共熔混合物是两种组分的混合物,药物通过微晶的形式存在于固体载体中,两组分在液态下可混溶,但在固态下不混溶。该技术提高溶解度的原理为药物通过形成微晶,有利于提高药物在溶解介质中的液-固接触,从而提高药物溶解度。
固态溶液无论成分有多少种,溶解性都可以与单一相的液态溶液相媲美。固态溶液中药物以分子形式均匀分布在固体载体中,由于固态溶液中药物的分散度较高,所以药物的溶出速率较大。
无定形共沉淀物即药物与载体以无定形的形式形成共沉淀物。由于药物不存在晶型,所以溶解时不需要克服晶格能,从而提高了药物的溶解度及溶解速率。
玻璃溶液即药物溶于熔融状态的无定形载体中,骤然冷却形成的固体溶液。由于玻璃溶液具有较小的晶格能,所以药物溶解时只需克服较小的晶格能即可溶解,从而提高了药物的溶解度及溶解速率。
固体分散体技术可形成小颗粒的固体颗粒,所以当小颗粒的药物在介质中溶解时,可改善药物的润湿性以及团聚现象。
结晶度和晶型的改变也可能影响药物的溶解度。
此外,载体本身的性质也可能影响药物的溶解度,如载体可以通过改善药物的润湿性和抑制药物从过饱和溶液中成核或沉淀来提高药物的溶解度。
制备方法
固体分散体的物理化学性质及其性能,是药物和载体的单独性质以及它们之间相互作用的性质。制备方法是影响这些性能的重要因素。
固体分散体可以使用熔融法或溶剂法进行制备。
熔融法需要将药物与载体的混合物进行熔融,然后经过冷却和固化得到固体分散体。使用熔融法制备固体分散体需要原料及载体都具有较好的热稳定性,这种限制可能让许多药物不能通过该方法进行制备固体分散体。但是通过熔融法制备固体分散体后可直接压片,可减少一些工艺步骤。
溶剂法需要将药物及载体溶解在有机溶剂中。该方法需要保证药物与载体在有机溶剂中的溶解度,最终产物需要去除有机溶剂残留。喷雾干燥就是一种溶剂法制备固体分散体的方法。
载体的选择
固体分散体的溶解度可以由载体控制也可以由药物控制。
如果通过载体来控制溶解,选择合适的载体则至关重要。选择载体时需要考虑的两个重要因素,即药物和载体的溶解性、药物和载体的相容性。
如果缺乏对药物和载体溶解性及相容性的认识,药物与载体可能会在所选溶剂中无法溶解,并且药物与载体可能发生物理、化学或生物不相容的现象。
目前大家经常用到的载体有聚乙二醇、聚乙烯醇、纤维素衍生物(羟丙基甲基纤维素、羟丙基纤维素等)、表面活性剂载体、糖类、醇类等等。
2、环糊精包合物
环糊精是由葡萄糖结合在一起形成的环状低聚糖化合物。环糊精在不需要分子修饰的情况下,可以与药物分子形成复合物,从而改善药物的理化性质。
环糊精是由葡萄糖单元通过α-1,4苷键结合形成的环状低聚糖,其具有亲水性的外表面和亲脂性的中心空腔。
α-环糊精、β-环糊精和γ-环糊精是天然产物。未被取代的天然α-环糊精、β-环糊精和γ-环糊精虽然是亲水性的,但在实际应用中,它们在水中的溶解性却受到了一定的限制,特别是β-环糊精。
因此,水溶性更好的β-环糊精衍生物,如2-羟丙基-β-环糊精被开发用于提高药物在水中的溶解度。
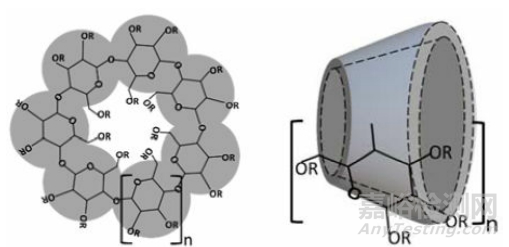
图3. 环糊精结构
环糊精可以将水溶性差、化学性质不稳定的药物输送到体内。
以环糊精作为主体分子,可将药物分子带入环糊精内部的空腔中,从而形成包合物。
包合物形成后会改变药物的一些物理化学性质,如增加药物在水中的溶解度,增加药物的物理及化学稳定性,也可以增强药物的渗透性。
在包合物形成的过程中没有共价键的形成和断裂,这是一种物理过程。
在水溶液中,结合在环糊精包合物中的药物分子与游离的药物分子保持动态平衡,当药物分子通过稀释溶液介质或竞争性络合时,药物分子很容易从包合物中释放出来。
一般情况一个或多个药物分子可以与一个环糊精分子形成包合物,一个或多个环糊精分子也可以与一个药物分子形成包合物。然而,最常见的是一个药物分子与一个环糊精分子形成包合物。
下图为包合物的形成过程。
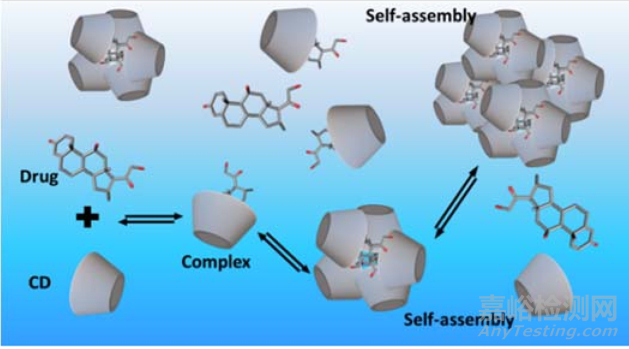
图4. 环糊精包合物形成及释放过程
环糊精包合物可以提高II类药物的口服生物利用度,也可能提高IV类药物的口服生物利用度,但是对I类及III类药物生物利用度的提高几乎没有作用。
3、自乳化药物传递系统
自乳化药物传递系统是由油相、水相、表面活性剂及助表面活性剂在一定的比例下自发形成的一种混合系统。该系统既可以是液态也可以是固态的。
固体自乳化系统可采用喷雾干燥、固体载体吸附、熔融造粒以及热熔融挤出等方法进行制备。
自乳化药物传递系统的助表面活性剂通常为短链醇,表面活性剂通常选用高HLB值的非离子表面活性剂,因为非离子表面活性剂毒性相对较低。
以脂质为基础的自乳化给药系统可增强药物的吸收,同时还能抑制P-糖蛋白介导的药物外流和吸收代谢、促进淋巴转运,从而防止肝脏首过代谢。
自乳化系统由于以脂质为基础,所以可增强胃肠道通透性,从而增强药物的吸收,并且能持续给药。
4、前体药物设计
前体药物是药理上不活跃的分子,需要酶或化学转化才能在体内释放活性母体药物,从而发挥药理作用。
前药设计是一种改善药物理化性质的方法,通过前药设计可以改善药物的渗透性、溶解性、生物利用度、化学稳定性等。
前药设计之成酯:
成酯一般适用于醇类或者羧酸类药物,一般来说需要载体为极性,从而提高前体药物的溶解度。前体药物进入体内后,酯键被酯酶水解,从而产生母体药物。
前药设计之成盐:
磷酸盐基团通常用作促进剂,以提高难溶性化合物的水溶性。前体药物可以通过羟基将磷酸部分直接连接到母体药物上,或者通过化学接头将其连接。磷酸盐前体药物通常表现出高水溶性、化学稳定性,并且由于磷酸酶的作用,其向母体药物的生物转化很快。
前药设计之酰胺化合物:
酰胺是胺和羧基官能团的衍生物,通常用作电离基团,从而提高药物的水溶性。但是在体内,酰胺化合物对酶稳定性较高,不利于水解,所以干扰了前体药物向母体药物的转化。
前药设计之N-曼尼希碱:
N-曼尼希碱是由氨基化合物(如酰胺、酰亚胺)与甲醛和脂肪胺或芳香胺反应形成的。因此,通过在酰胺中引入一个可电离的氨基,在弱酸性的pH下,药物的水溶性大大增强。在含水的碱性环境中,N-曼尼希碱分解,释放母体药物。
5、共晶
共晶体是一种结构均匀的晶体材料,含有两个或两个以上活性的电中性物种,通过非共价力以一定的比例结合于一起。
目前,共晶技术是制药行业中比较受欢迎的方法。通过蒸发溶剂、不同组分研磨在一起、升华等方法可制备共晶物。
共晶提高了药物的溶解度、溶出速率、生物利用度以及药物的稳定性。
共晶是成盐的另一种技术,用于中性化合物。
共晶体的物理化学性质的研究在药物开发中非常重要。这些性质包括结晶度、水溶性、熔点、溶出度以及稳定性,这些都需要进行深入的研究。
熔点是固态和液态处于平衡状态的温度。这一参数对于固体药物的开发非常重要,一般共晶体的熔点要更低一些。通过比较原料药和其共晶体的熔点,熔点越高,一般溶解度越低。
稳定性是共晶体的参数之一。大多数新开发的处方都需要进行稳定性试验,如高湿、高温、光照等条件的考察,我们需要通过这些考察,确定共晶体的最佳贮存条件。
溶解度也是共晶体的重要参数之一。
药物共晶在增加溶解性差的药物的溶解度方面具有很大的潜力。
6、共溶剂
药物在共溶剂中的增溶是一种改善药物溶解度的技术,可通过改变溶剂的极性,从而改善药物的水溶性差的问题。
例如,弱电解质和非极性分子的溶解度可以通过添加另一种溶剂(称为共溶剂)来改善,这一过程称为共溶。
溶剂通过溶剂混合的机制降低了水相和疏水相之间的界面张力,从而增加了药物的溶解度。
7、改变药物晶型
许多药物具有多晶型,不同的晶型具有不同的理化性质,如溶解度、溶出速率、熔点和稳定性。
药物的不同晶型具有不同的溶解度,一般无定形>亚稳态晶型>稳定晶型。但是当使用无定形或亚稳态晶型药物时,应在药品研发及产品贮存过程中重点关注药物的晶型是否发生转变。
8、改变制剂pH
通过对固体制剂进行pH修饰也可以提高电离药物的溶解度及溶出速率。在固体剂型中加入pH调节剂改变电离药物的化学稳定性和微环境pH,同时通过改变药物的解离来影响药物的溶解度。
该技术在缓控释制剂中应用较多,速释剂型中应用相对较少。
9、微粉化
我们都知道药物的溶解度与药物的颗粒大小是有一定关联的。当药物颗粒颗粒变小时,由于比表面积增大,溶解度可能增加。
传统的粒度减小方法有喷雾干燥法、冷冻干燥法、结晶法和研磨法。随着药物微粉化,比表面积增加,从而增加了药物的溶解度并提高了药物的溶出速率。
10、脂质体
脂质体可通过脂质分子将药物分子包于内部。根据脂质体大小、双分子层的数量和囊泡内部囊泡的存在,脂质体可分为五种类型:多层脂质体(MLV)、大单层脂质体(LUV)、小单层脂质体(SUV)、寡层大脂质体(OLV)和多囊泡脂质体(MVV)。
当口服给药时,由于胃、肠酶和胆盐的低pH值,脂质体会迅速降解。对于酸不稳定的药物,如头孢噻肟,脂质体制剂为药物提供了暂时的保护,使其免受胃中不利的酸性环境的影响,同时增强了肠渗透性。
脂质体可以将脂溶性药物包裹在囊泡疏水基团的夹层中,阻止药物颗粒间结合,增加药物的溶解度。
总结
药物的口服给药途径通常是我们制剂开发中优先选择的,因为口服制剂给药方便、患者耐受性强并且成本相对较低。但是大多数药物溶解性较差,药物溶解性差就会减缓药物的吸收,导致药物的生物利用度降低,甚至会由于药物的沉积导致胃肠道粘膜毒性。
因此,如何使用好这些技术与方法,提高药物溶解度,从而最大限度地发挥疗效,是让更多药物更好地造福大众的关键。
参考文献:
周庆辉, 平其能. 自乳化药物传递系统的应用与前景[J]. 药学进展, 2001, 25(3):134-138.
林瑞来. 难溶性药物溶解度的提高方法[J]. 中国医药指南, 2010(03):34-35.
Singh A , Worku Z A , Guy V . Oral formulation strategies to improve solubility of poorly water-soluble drugs[J]. Expert Opinion on Drug Delivery, 2011, 8(10):1361-78.
Porat D , Dahan A . Active intestinal drug absorption and the solubility-permeability interplay[J]. International Journal of Pharmaceutics, 2017:S0378517317310384.
Sanches B , Ferreira E I . Is prodrug design an approach to increase water solubility?[J]. International Journal of Pharmaceutics, 2019, 568:118498.
Phennapha S , Chutimon M , Phatsawee J , et al. Solubility of Cyclodextrins and Drug/Cyclodextrin Complexes[J]. Molecules, 2018, 23(5):1161-.
[7]Sumit, Kumar, Deepak, et al. Drug carrier systems for solubility enhancement of BCS class II drugs: a critical review.[J]. Critical reviews in therapeutic drug carrier systems, 2013, 30(3):217-56.

来源:铭研医药


