您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2021-06-04 08:54
更多医药技术资讯,请点击医药专栏:http://drug.anytesting.com/ 欢迎关注文末微信公众号:药研检测drugtest
「 本文共:16条资讯,阅读时长约:3分钟 」
今日头条
圣和PRMT5抑制剂国内获批临床。圣和药业PRMT5小分子抑制剂SH3765片获国家药监局临床试验默示许可,拟用于治疗晚期恶性肿瘤,包括但不限于实体瘤、非霍奇金淋巴瘤等。圣和药业正在中美同步推进SH3765的临床开发,该新药今年2月已获FDA临床试验许可。目前,全球尚无PRMT5抑制剂获批上市,进展最快的同类产品是葛兰素史克的GSK3326595,目前处于II期临床开发阶段。
国内药讯
1.豪森「盐酸鲁拉西酮片」即将获批上市。江苏豪森4类仿制药「盐酸鲁拉西酮片」的上市申请变更为“在审批”状态,预计即将获批上市,成为该品种第二家获批的国产仿制药。鲁拉西酮(Latud)是由住友制药原研的一款非典型(第二代)抗精神病药物,为多巴胺D2、5-HT2A及5-HT7受体拮抗剂。原研药盐酸鲁拉西酮(Latudal/罗舒达)于2019年1月已获批进口中国,用于成人精神分裂症的治疗,目前该原研已进入医保目录。
2.泽璟制药治疗斑秃新药上Ⅲ期临床。泽璟制药登记启动一项小分子JAK抑制剂新药盐酸杰克替尼片治疗重症斑秃的Ⅲ期临床。该项临床旨在确证盐酸杰克替尼片治疗重症斑秃的有效性,安全性和药代动力学特征。该研究计划在中国境内入组354人,将由北京大学人民医院主任医师张建中博士、中国医学科学院皮肤病医院主任医师陆前进博士担任主要研究者。
3.杭州博际新药BJ-005获FDA临床许可。博际生物PD-L1/TGF-β双功能性融合蛋白BJ-005获FDA批准,即将在美国开展临床试验。BJ-005可同时靶向PD-L1和TGF-β,通过靶向免疫检查点和调节肿瘤细胞生长的细胞因子途径来抑制肿瘤生长,用于治疗癌症患者。这是该公司继2019年肿瘤靶向性IL-15融合蛋白(BJ-001)在美国获批临床后,第2款获FDA临床许可的自主研发产品。
4.住友治疗精神分裂症新药国内获批临床。住友制药新型TAAR1受体激动剂SEP-363856片获国家药监局四项临床试验默示许可,拟开发用于治疗精神分裂症。SEP-363856是一种具有全新作用机制的抗精神疾病药物,全球范围内已处于Ⅲ期临床开发阶段。2019年5月,FDA已授予该候选药用于治疗精神分裂症的突破性疗法认定。
5.联拓生物联手Lyra开发慢性鼻窦炎药物。Lyra Therapeutics公司宣布与联拓生物就其拟用于治疗慢性鼻窦炎(CRS)的临床后期产品LYR-210达成战略合作和许可协议,双方将在大中华区(中国大陆以及港澳台地区)、韩国、新加坡和泰国联合开发和商业化LYR-210。根据协议,Lyra将获得1200万美元的首付款、最高可达1.35亿美元的开发、监管和商业化里程碑付款;联拓生物还将获得在许可区域内开发和商业化LYR-220的优先权利。
国际药讯
1.首创三萜类抗真菌剂获FDA批准上市。FDA批准Scynexis公司创新口服葡聚糖合成酶抑制剂Brexafemme(ibrexafungerp)上市,用于治疗外阴阴道念珠菌病(VVC,也称为阴道酵母菌感染)。Brexafemme属于“first-in-class”三萜类抗真菌剂,也是首个治疗阴道酵母菌感染的非唑类疗法。豪森药业拥有在大中华区开发和商业化ibrexafungerp的独家权益。值得一提的是,这也是FDA今年批准的第25款新药,批准速度创同期新高。
2.Opdivo+Yervoy组合一线治疗MPM获欧盟批准。欧盟委员会批准百时美施贵宝(BMS)Opdivo+Yervoy组合用于一线治疗不能手术切除的恶性胸膜间皮瘤(MPM)成年患者。在一项Ⅲ期临床CheckMate-743研究中,与标准护理化疗(培美曲赛+顺铂或卡铂)相比,这一组合显著改善总生存期(中位OS:18.1个月vs14.1个月)。截至目前,Opdivo+Yervoy组合在欧盟已被批准治疗4种不同的晚期癌症:间皮瘤、非小细胞肺癌、黑色素瘤、肾细胞癌。
3.诺华Cosentyx获批用于儿童斑块型银屑病。FDA批准诺华重磅产品Cosentyx用于6 岁及以上患有中重度斑块型银屑病的儿科患者。此次新批准是Cosentyx在美国用于儿科人群的首次批准。值得一提的是,该公司日前也发布了Cosentyx用于治疗幼年特发性关节炎(JIA)的阳性III期JUNIPERA研究数据。与安慰剂相比,Cosentyx显著延迟两种不同类型JIA儿童的发作时间;而且该治疗组更多的患者的临床反应从12周维持到104周。
4.艾伯维JAK抑制剂治疗RA长期疗效积极。艾伯维JAK抑制剂Rinvoq(upadacitinib)在治疗中重度类风湿性关节炎(RA)的Ⅲ期临床达到主要与次要终点。Rinvoq与甲氨蝶呤(MTX)联用在3年内的临床缓解率(CR)为32%,低疾病活动度(LDA)为37%,要优于对照组(修美乐与MTX联用,CR为22%,LDA为26%)。此外,超过四分之一的患者在3年时达到临床缓解,且在随访4.5年内的安全性特征一致,未观察到新的安全性风险。详细数据将在EULAR 2021大会上公布。
5.骨髓纤维化新药获FDA优先审评资格。FDA受理CTI BioPharma口服激酶抑制剂pacritinib的新药申请,用于治疗伴有严重血小板减少症的骨髓纤维化患者。FDA同时授予其优先审评资格,预计11月30日前做出回复。研究结果表明,与活性对照组相比,pacritinib治疗组脾脏体积缩小了至少35%的患者比例更高(29%vs3%),总症状评分至少降低50%的患者比例也更高(23%vs13%),而且不良事件通常为低级别。
6.默克PD-L1/TGF-β双抗拟联合LAG-3疗法开展临床。Immutep公司“first-in-class”LAG-3融合蛋白Eftilagimod(efti或IMP321)与德国默克PD-L1/TGF-β双抗将开展一项I/IIa期临床INSIGHT-005研究,评估联合用药在实体肿瘤患者中的安全性和有效性。Immutep公司旨在探索人体免疫系统在癌症免疫周期的三个不同位点相互作用的效果。该试验预计将在2021年年中登记首例受试者,将在2022年初提供首个研究数据。
医药热点
1.国内首家“三孩”生育咨询门诊开设。江苏南京的东南大学附属中大医院妇产科于6月1日推出“三孩”生育咨询门诊,每周一至周六在该院本部门诊大楼7楼产科门诊对外开放,为国内首家。该门诊也可以接诊想要生一胎、二胎的咨询者,为所有有生育需求特别是三孩生育的咨询者,提供专业、科学的咨询指导和生殖健康管理。
2.3名药企候选人进入第二轮院士评审。中国工程院2021年院士增选进入第二轮评审候选人名单6月2日公布。经中国工程院院士增选第一轮评审,产生进入第二轮评审候选人235位。药学相关专业中,有5人进入了第二轮的评审候选人,其中3名来自于药企,分别为江苏康缘药业肖伟、中国生物技术公司杨晓明、云南白药集团朱兆云。
3.中国首批供应COVAX疫苗下线。6月1日,国药集团中国生物北京生物制品研究所首批供应COVAX(新冠肺炎疫苗实施计划)的新冠疫苗下线,这也是首批供应COVAX的中国新冠疫苗。纳入COVAX的疫苗将作为全球公共产品,为实现疫苗的可及性和可负担性做出中国贡献。目前,我国已有2款新冠疫苗被世卫组织列入紧急使用清单。
4.口腔细菌或能激活致癌基因。圣保罗大学(USP)的科研人员日前在《Frontiers in Cellular and Infection Microbiology》杂志发表了一篇题为Proto-Oncogenes and Cell Cycle Gene Expression in Normal and Neoplastic Oral Epithelial Cells Stimulated With Soluble Factors From Single and Dual Biofilms of Candida albicans and Staphylococcus aureus 的最新研究,对口腔中的细菌与头颈癌的潜在联系进行了一系列的分析。研究发现,口腔中的真菌和细菌不仅会导致牙周炎、龋齿等疾病,还会激活头颈癌相关基因的表达。
审评动向
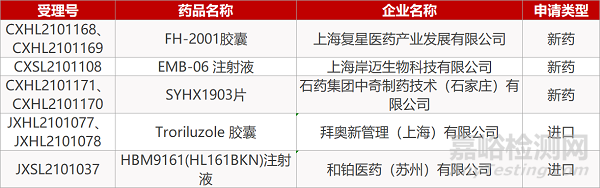
1. CDE新药受理情况(06月03日)
申请临床:
上海复星的FH-2001胶囊(2个规格)、上海岸迈的EMB-06 注射液、石药集团中奇制药的SYHX1903片(2个规格)、拜奥新的Troriluzole 胶囊(2个规格)、和铂医药的HBM9161(HL161BKN)注射液。
申请生产:
2. FDA新药获批情况(北美06月01日)


来源:药研发


