您当前的位置:检测资讯 > 法规标准
嘉峪检测网 2021-03-20 23:09
摘 要 / Abstract
儿童药品是基本的民生保障,儿童用药的安全问题则是各国面临的共同挑战。儿童药品剂型和规格缺乏、专用药少、用药安全面临风险等问题在我国长期存在。在加快儿童药品上市的同时,需加强儿童药品全生命周期的风险管理和控制,建立符合儿童特点的药品风险管理体系和保险制度,确保儿童用药安全。
Pediatric drugs provide essential guarantee for children’s welfare, while the safety of pediatric drugsis a common challenge faced by all countries. The lack of dosage forms and specifications for pediatric drugs,lack of pediatric-focused drugs and the safety risks posed by pediatric drug use are long-standing problemsin China. In addition to assuring faster access to pediatric drugs, it is necessary to enhance total life cycle riskmanagement and risk control of pediatric drugs and to establish a risk management system and insurancesystem best suited for children so as to ensure the safety of pediatric drug use.
关 键 词 / Key words
儿童药品;挑战;风险管理;保险制度;用药安全
pediatric drugs; challenge; risk management; insurance system; safety
2019年国家统计局统计数据显示,我国0~14岁人口总数约为2.3亿人,占总人口数的16%。每年的患病儿童数约占总患病人数的20%左右。根据《2019年我国卫生健康事业发展统计公报》,2019年我国出生人口为1465万人。面对如此庞大的儿童人口基数,儿童药品市场潜力巨大,加快建立和完善科学的风险管理体系是保证儿童用药健康、规范、安全发展的重要措施。
01、儿童用药风险管理特点
儿童用药是指供儿童使用的药品,将年龄作为儿童用药的划分依据是各国公认的做法。根据我国儿科学的定义以及国际惯例,将儿童明确为18周岁以下的特殊群体。儿童用药界定为供18周岁以下特殊群体使用的药品。
由于儿童具有特殊生理特点,处在生长发育阶段,生理功能变化大,机体各器官系统功能尚未成熟,儿童用药风险管理具有如下特点。
(一)长期性
由于药物可能影响儿童生理以及认知能力的发育,一方面儿童受到损害后,其生理、心理影响持续的时间更长,后果更严重;另一方面对于儿童药物的安全性需要开展长期研究,收集其对生长发育影响的数据,判定药物对骨骼、行为、认知、性器官和免疫系统的成熟与发育的可能作用。
(二)复杂性
由于儿童的特殊生理特点,其发生药害事件的可能性相比成人大大增加,损害发生的类型也更多样。同时,由于儿童心理上的敏感性、不稳定性以及不成熟性,损害发生的原因也具有不可预测性。
(三)社会敏感性
儿童是每个家庭的希望,伴随着社会的发展,对于儿童损害的社会关注度极高。由于儿童受试者在生理上的特殊性,药害风险出现的几率较大,甚至会造成儿童伤残或者死亡,也可能引起家庭破裂以及医患关系紧张,加剧社会矛盾。
02、儿童用药风险管理现状
儿童用药的风险涉及研发、生产、流通和使用等多个环节,包括临床试验的相关风险、产品质量责任和不良反应发生的风险、运输和存储的风险、医疗执业和用药救治的风险等。药品上市许可持有人始终是风险管控的第一责任主体,生产企业、经营企业、医疗机构等则是不同环节的责任主体或负连带责任,应与监管部门、媒体、学校、家长和个人等共同应对风险、处置风险和化解风险。
(一)儿童用药风险管理流程
一般来说,药品的风险管理分为4个阶段:①风险识别。即对面临的和潜在的风险进行判断、归类,鉴定风险性质。②风险评估。即在识别的基础上,预判风险因素发生的可能性、严重程度及由此造成的影响。③风险控制。即根据风险评估结果,按照风险管理的目标,选择最佳的风险控制手段,包括建立药品追溯制度、药品不良反应监测及药物警戒制度、药品召回制度等;针对损害,通过保险或自行协商方式进行赔偿;暂停或终止临床试验、报告严重不良事件(serious adverse event,SAE),以及加强与媒体和公众的风险交流等措施。④风险监控。即对现实风险进行监控,对风险管理手段适用性及收益性进行分析、修正和评估。
(二)儿童用药风险管理规制现状
坚持全过程风险管理理念是儿童药和成人药共同要遵守的准则。目前我国尚未出台儿童用药的专门法律法规,现有的药品法规中也没有针对儿童用药风险管理的专门条款,只是归在药品大类中进行管理。儿童用药的法律适用仅是一般性的规定,且整体法律层级不高。
1.法律法规对儿童知情权进行了单独的规定
为保护儿童受试者权益与安全,《疫苗管理法》和《药物临床试验质量管理规范》(Good Clinical Practice,GCP)对儿童受试者的知情权进行了规定。《疫苗管理法》第十八条规定,开展疫苗临床试验,应当取得受试者的书面知情同意;受试者为无民事行为能力人的,应当取得其监护人的书面知情同意;受试者为限制民事行为能力人的,应当取得本人及其监护人的书面知情同意。GCP第二十三条规定,儿童作为受试者,应当征得其监护人的知情同意并签署知情同意书。当儿童有能力做出同意参加临床试验的决定时,还应当征得其本人同意,如果儿童受试者本人不同意参加临床试验或者中途决定退出临床试验时,即使监护人已经同意参加或者愿意继续参加,也应当以儿童受试者本人的决定为准,除非在严重或者危及生命疾病的治疗性临床试验中,研究者、监护人认为儿童受试者若不参加研究其生命会受到危害,这时其监护人的同意方可使患者继续参与研究。在临床试验过程中,儿童受试者符合签署知情同意的条件时,需要由本人签署知情同意之后方可继续实施。法律法规除对儿童知情权有特殊规定外,其他均未针对儿童有特殊要求。
2.明确“样本量最小、标本最少、痛苦最小”是儿童临床试验的基本原则
2016年原国家食品药品监督管理总局制定出台了《儿科人群药物临床试验技术指导原则》,强调“样本量最小、标本最少、痛苦最小”是儿童临床试验的基本原则。指导原则虽然不具有强制性的法律约束力,但代表了药品监管部门的观点和认识,对于儿童用药临床试验具有广泛的引领作用。围绕上述原则,近期又陆续出台《成人用药数据外推在儿科人群药物临床试验及相关信息使用的技术指导原则》《真实世界研究支持儿童药物研发与审评的技术指导原则(试行)》《儿科用药临床药理学研究技术指导原则》等,伴随技术指南的完善,我国儿童用药临床试验的技术体系已经初见端倪。
3.对儿童受试者的保险和补偿有原则性规定
《儿科人群药物临床试验技术指导原则》中提及,鼓励在儿科人群药物临床试验中纳入保险赔偿机制。应在试验方案中详细写明保险与补偿方式,需要伦理委员会审核批准。试验过程中发生意外医疗事件时,相关机构和研究者有义务对受试者提供紧急医疗救助。紧急医疗救助和随后的医学治疗的范围,以及由谁承担费用,应在知情同意书中明确写明。保险与补偿方式是伦理审查的重点,这一点无论是儿童还是成人都是一致的。与成人的区别是进一步强调了紧急医疗救助,这也体现了对于儿童受试者一旦发生不良事件要第一时间救治,从而最大程度减少损害的基本原则。
(三)儿童用药风险管理实践中的问题
1.临床试验阶段
与成人临床试验相比,儿童临床试验在伦理学考虑、入选操作和评价方法等诸多方面具有特殊性,并存在一定的困难。由于儿童临床试验存在多方面的阻碍因素,儿童用药临床试验综合成本高,企业开展儿童临床试验的动力不足。虽然近年来我国对儿童用药采取了积极的审评策略,通过对“药物临床试验机构备案管理信息平台”登记的临床试验数据进行统计,儿童试验每年只有30~40项左右,数量无显著增长,仅占全部药物临床试验数的2%左右。
(1)临床试验机构相对较少,多数机构风险管理经验不足
在我国,儿童临床试验应在国家药监局认可的儿科人群药物临床试验机构进行;同时要求参与儿童药物临床试验的研究者需要接受良好培训,具有儿科研究经验,具备判断、处理和评价儿科不良事件的能力,特别是对紧急而严重的不良事件的处理能力。从儿童临床试验机构数量来看,根据国家药监局资格认可公告统计,截至2019年10月31日,894家被公告的医疗机构中含儿科专业的医疗机构共158家,占比18%;其中儿童专科医院及妇幼医院共计32家,有资质的儿童药物临床试验机构相对缺乏。虽然有资质的儿童临床试验机构超过100家,但从实际承接试验来看,在“药物临床试验登记与信息公示平台”中登记的儿童临床试验只涉及49家临床试验机构,不少儿童临床试验机构尚无实际操作经验。无论是从临床试验机构的数量,还是从临床试验机构的专业性来看,当前我国专业儿童临床试验机构并不充足,研究质量不高,也未形成系统性网络。
(2)针对儿童受试者损害的保障不足
根据GCP要求,申办者应当采取适当方式保证给予受试者和研究者补偿或者赔偿。申办者应当向研究者和临床试验机构提供与临床试验相关的法律上、经济上的保险或者保证;该保险或保证应与临床试验的风险性质和风险程度相适应。GCP对于损害赔偿和补偿只是进行了原则性的规定,但是对很多实践中的具体问题均未有明确规定,包括:何为试验相关的损害,临床试验适用过错责任还是无过错责任,是遵从现有法律对于人身损害的要求还是考虑到临床试验的特殊性有额外的规定,儿童受试者和成人受试者是否一样等。
2.上市后阶段
(1)儿童用药品种较少
国内市场常用的3000多种处方药中,儿童药品所占比重不足5%。以北京儿童医院为例,尽管在遴选药品时尽可能优先选择适宜儿童的品规,但儿童专用药品仅有不足4%,其中处方药更少,仅为2%,见表1。
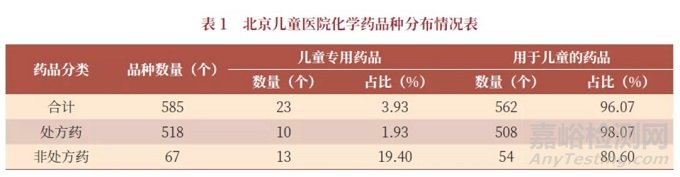
根据北京儿童医院《儿童用药现状调查》课题调查显示,15家医院儿科用药共同目录1098种药品中,儿童专用药品极少,仅45种(4.10%)。此外,90%的药品缺乏儿童适用剂型和规格,临床上往往不得已采用成人药品剂型或规格,酌情减量后给儿童使用。
(2)说明书儿童用药信息不全
多数药品说明书中未注明儿童用法用量,或仅标识“儿童酌减”或“儿童遵医嘱”,缺乏儿童疗效和安全性数据。以北京儿童医院为例,677个品规中,312种(46%)无儿童用法用量;365种(54%)有儿童用法用量,其中又有96种(26%)标明某些年龄段禁用、慎用或安全性不明确等。
(3)超说明书(off-label)用药情况较多
在临床实践中,由于可供儿童使用的药品品种、剂型及规格少、说明书信息不全等,现有儿童用药不能满足临床用药需求。在儿童用药领域,超说明书用药的情况比比皆是。超说明书用药是指药品使用的年龄、适应证、给药方法、剂量及给药途径不在厂家提供的药品说明书之内的用法。以北京儿童医院为例,对10 716张门诊处方审查的结果显示,有53%的处方存在超说明书用药的情况;通过对12987份住院医嘱审查的结果显示,有27%的医嘱存在超说明书用药的情况。
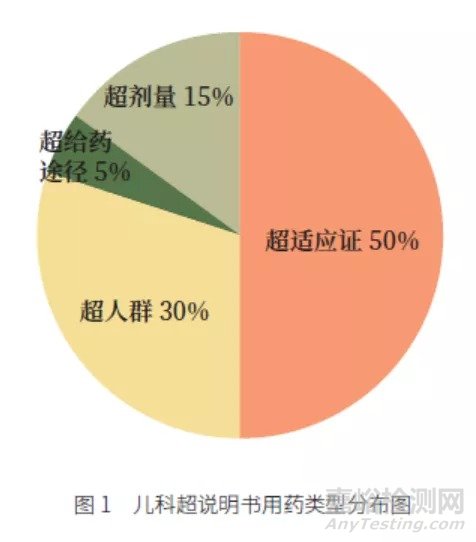
《儿科用药处方审核规范的建立》课题组统计显示,儿童超说明书用药中,最主要的是超适应证用药,约占50%,其次为超人群用药,占30%,见图1。尽管超说明书用药存在其合理性,但潜在的法律风险不可忽视[1]。
(4)儿童药品的不良反应不容忽视
《国家药品不良反应监测年度报告(2019年)》显示,2019年全国药品不良反应监测网络收到《药品不良反应/事件报告表》151.4万份,其中14岁以下儿童患者占10.2%,约为15.44万份。2019年儿童药品不良反应/事件报告中,注射剂占77.6%,口服制剂占16.4%。提示儿童作为特殊用药人群,受脏器发育尚未完全等因素影响,对药物更为敏感,耐受性较差,需重点关注其注射用药风险。通过上市后不良反应的数据可以看出,儿童是高风险群体,其用药的不良反应不容忽视,提高儿童用药的安全性、减少儿童用药不良反应发生的工作迫在眉睫。
03、加强儿童用药风险管理的建议
通过学习研究和借鉴国外儿童用药法规制度和风险管理的经验[2-5],提出加强我国儿童用药风险管理的几点建议。
(一)针对儿童用药单独立法
目前,我国没有专门针对儿童用药的法律法规,关于儿童用药的有关规定大多分散在多部药品法规中,且缺乏系统监管。国家卫生健康委前期会同相关部门开展了一系列研讨和论证工作,形成《儿童用药保障条例(初稿)》,包括儿童用药研发、生产、流通、使用、综合评价等方面内容。伴随着新修订的《药品管理法》、新出台的《疫苗管理法》的实施,儿童用药立法已经具备充分的可行性,建议参考《疫苗管理法》的立法形式,对儿童用药单独立法,在条例初稿的基础上,广泛征求社会各方意见,并加强与现行药品管理法的衔接,加快推进立法工作。
(二)建立政产学研用金多方协作、紧密联系的长效机制
儿童是国家的未来,儿童用药的风险管理需要全社会的共同参与,各部门和单位之间的通力合作是实现儿童用药安全有效的有力保障。要加强正面宣传和科学引导,让社会各界高度重视、高度理解儿童用药风险发生的必然性以及不确定因素,传播正能量和好声音,塑造行业好形象,营造和谐医患关系氛围;要建立政产学研用金多方协作、紧密联系的长效机制,调动药品监管机构及其他政府相关部门、药品研发机构、生产企业、医疗机构、学术界、金融界、教育界以及法律界等,围绕儿童药品风险管理的理论、路径、实操等开展紧密合作,共同推动儿童药品风险管理工作。
(三)形成符合儿童特点的以保险为重要手段的风险管理指引
为了使儿童得到全方位的安全保障,参考国际经验,借鉴疫苗异常反应补偿的相关方式,建议围绕儿童药品全生命周期(包括临床、上市后等)制定分阶段的以保险为重要手段的风险管理指引,并按照药品、医疗器械、疫苗等予以区分,形成科学、可操作的“中国儿童用药风险管理指引”。考虑到儿童风险管理特点,在现有的保险机制下,适当扩展保障范围,涵盖儿童用药风险管理需要;简化鉴定流程,体现人文关怀;同时为了保证儿童用药损害后能够快速、有效地得到赔偿/补偿,商业保险应采用零免赔、高保额的模式,儿童用药发生的损害都在保险范围内承担,最大限度体现保险对维护儿童这一特殊群体权益的保障作用。此外,要积极探索建立政府、企业、福利组织和慈善机构等共同参与的药物损害补偿基金,开辟多种渠道和方式解决好儿童用药风险管理问题。
(四)将“超说明书用药”变成“说明书内用药”
考虑到儿童用药面临的超说明书使用问题,建议围绕超说明书用药问题加强风险控制,建立合理的工作机制,将“超说明书用药”尽快变成“说明书内用药”。一方面鼓励药品生产企业针对儿童群体积极开展由研究者发起的上市后药品临床试验;另一方面建立儿童药品信息共享平台,药品生产企业可以第一时间获得超说明书用药信息,企业及时研究、评估,提出修订说明书的注册补充申请。
(五)完善相关配套措施
建议参考欧美国家的管理方式,对儿童临床试验进行风险分级,形成不同的伦理审查要点,汇总成我国《儿童临床试验伦理审查指南》,进一步明确儿童受试者的权利,以及研究者和申办者的义务和法律责任;同时进一步细化药品监管机构的权利和责任。

来源:中国食品药品监管杂志


