您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2021-03-12 00:12
流感是由流感病毒引起的一种急性呼吸道传染病,每年在全球导致10亿人感染,流感疾病负担主要集中在儿童和老年人群体,流感爆发也会给社会造成巨大经济损失。全球公认预防流感最有效的手段是接种流感疫苗。造成流感疫苗的保护效力下降的因素很多,疫苗株与季节性流感病毒流行株不匹配就是其中最主要的原因之一,幸运的是流感减毒活疫苗可以通过交叉免疫提供给受种者更多保护来降低这种风险。本文简单介绍了流感病毒灭活疫苗和流感减毒活疫苗,以及流感减毒活疫苗交叉保护机制。
1. 流感病毒疫苗的简介
1.1流感病毒灭活疫苗
将流感疫苗生产用毒种经培养增殖并利用特定手段灭活后制备成的疫苗称为流感病毒灭活疫苗。目前世界范围内,流感病毒培养基质主要有鸡胚和哺乳动物源细胞两种,常用的病毒灭活剂为甲醛或β-丙内酯。流感病毒灭活疫苗主要包括亚单位疫苗、裂解疫苗和全病毒疫苗。这类疫苗的生产用毒株主要由世界卫生组织(以下简称WHO)提供,WHO每年根据对全球流感流行的监测情况,推测并公布下一个流感流行季的病毒株用于流感疫苗生产。但是通过这种预测流行病毒株方式制备的流感疫苗存在不确定性,一旦疫苗株与流行株不匹配,将会导致疫苗无法提供有效的保护,迄今为止已有多次不匹配事件发生。保护率下降的根本原因在于流感病毒灭活疫苗的主要有效成分是血凝素(以下简称HA)和神经氨酸酶(以下简称NA)蛋白,这两种蛋白诱导机体产生的中和抗体是疫苗产生保护效果的最主要因素,而HA蛋白易变异,从而产生新的流感病毒亚型,但是HA抗原刺激机体产生的抗体特异性强,由此诱导产生的中和抗体无法有效中和变异后的流感病毒,因而无法应对由于流行株变异而引起的流感大流行。
除HA及NA蛋白外,流感病毒还包含了多种蛋白,流感病毒的蛋白组成见图1。
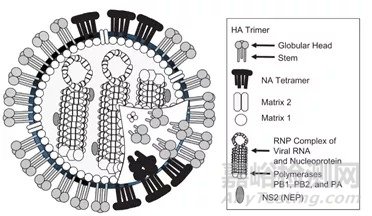
图1 流感病毒
1.2流感减毒活疫苗
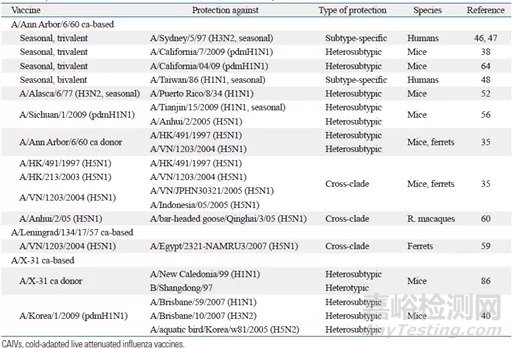
流感减毒活疫苗生产用毒种是通过将WHO推荐的当季流感流行株与具有减毒特性的主供体株进行重配,获得既包含流行株的HA和NA蛋白又具有减毒特性的流感病毒减毒株。将该毒种接种至SPF鸡胚尿囊液中培养增殖并经过纯化后制成流感减毒活疫苗。这类疫苗通过鼻腔喷雾方式接种,成为难以接受针剂注射儿童的最优选择。接种后,病毒会在鼻粘膜部位进行有限的增殖,这是个模拟自然感染的过程,会诱导包括粘膜免疫等多种免疫反应联合产生保护作用,这是流感减毒活疫苗发挥作用的主要方式。另外可以观察到一个有趣的现象:交叉免疫保护的发生。有多篇文献报道了这一现象:志愿者在接种H7N3减毒活疫苗后,当H7N9病毒流行时,44.8%的H7N3减毒活疫苗受种者检测出针对H7N9病毒的抗体阳转[1, 2];幼猪在接种H1N1减毒活疫苗后,可以抵御H1N2的感染[3]。更多的临床试验结果见表1。这些试验结果表明流感减毒活疫苗具有交叉免疫保护,进一步推测出当变异的流感病毒大流行时,流感减毒活疫苗的保护会更广泛。
表1.冷适应流感病毒减毒疫苗试验及临床数据
2.产生交叉保护的原因
2.1 CTL反应
CTL 反应是MHC-I类分子介导的CD8+T细胞参与的细胞毒作用,当病原体感染并入侵细胞后,这种毒性CD8+T细胞可以快速杀死宿主细胞,阻止病毒扩散。研究显示CTL反应在激活交叉保护时会起到关键作用。CTL的激活取决于MHC-I类分子是否识别到了有效的抗原,而流感病毒中对应MHC-I分子的抗原主要集中在病毒内部,如M1蛋白及NP蛋白,这两种蛋白只有在增殖过程中会暴露,因此只含有HA和NA的灭活流感疫苗难以激活CTL反应。M1是流感病毒的基质蛋白,根据文献报道,多肽与HLA分子的复性试验表明,在M1特定的T细胞表位多肽与HLA-A结合后,可以促进记忆性CD8+T的产生,从而增强CTL反应。跟据文献报道,1918年和2009年流行的的甲型流感病毒在M1蛋白上共有6个相同的CD8+T细胞抗原表位,这说明M1蛋白是一种极度保守的蛋白,这也是其诱导的CTL具有交叉保护的原因之一[4]。图2展示了记忆CD8+T细胞的形成过程。
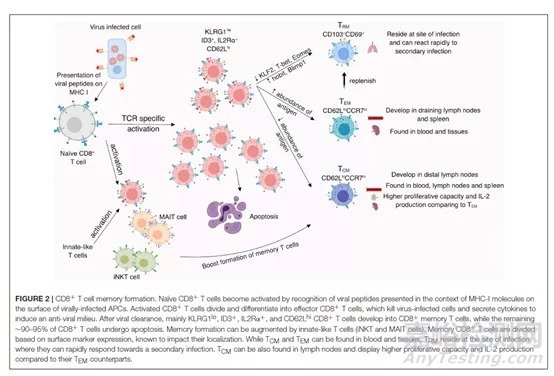
图2
2.2 IgA
通过鼻腔给药,流感病毒会直接和上呼吸道黏膜接触,黏膜受到感染后,大量的分泌型IgA抗体生成[5],分泌型IgA(sIgA)是黏膜免疫的主要效应因子,sIgA同样参与刺激受种者产生交叉免疫保护,关于IgA发挥交叉保护的原因主要基于分泌型IgA是一种多聚体,多种特异性IgA经过聚合,其不仅可以提供针对某种流感病毒的保护,也可以对同源甚至异源的流感病毒起到保护作用[6],这些结论都是经过验证的,比如通过鼻腔免疫H1N1(PR8)后的小鼠可以抵御PR8同源流感病的感染[7]。
2.3 NP蛋白的非中和抗体作用
NP蛋白也可以诱导机体产生特异性IgG抗体,但是这种IgG并没有中和活性。研究发现,这种IgG对于记忆性CD8+T细胞的增殖会起到促进作用,从而增强CTL反应。
2.4 中和抗体作用
针对HA蛋白的特异性抗体IgG是机体对抗病毒感染时起关键作用的分子,在HA中有多个保守序列,其中也含有抗原表位,流感疫苗减毒株中含有流行株的HA和NA抗原表位,所以其存在保证了疫苗最基本的有效性。能否通过这些序列进一步开发通用流感疫苗目前也正在被研究。减毒活疫苗是将流感病毒整体注射进人体,机体免疫系统对于病毒的识别比亚单位疫苗更加全面,其中包括更加保守的结构蛋白,这些结构蛋白诱导产生的抗体对于交叉中和保护也可起到一定作用。
2.5 固有免疫
固有免疫在机体被减毒活疫苗毒株感染时可以立刻提供保护,虽然这种保护是非特异性且短暂的,但是它诱导细胞因子或趋化因子,用于干扰病毒增殖、激活非固有免疫、协助健康的细胞抵御病毒感染等。有研究显示接种了H3N2减毒活疫苗的所有小鼠在最初的3~4天可以通过固有免疫的保护抵抗H1N1病毒感染[8]。
3. 流感减毒活疫苗的进一步研究
3.1野毒株序列的替换
因为NP蛋白是激活CTL反应的关键蛋白,所以有研究将减毒株中的NP蛋白用野毒株进行替换,发现对于病毒的增殖无影响,且疫苗的交叉保护作用进一步被强化[9]。也有研究将HA蛋白的核酸序列进行改造,添加更多B细胞受体的抗原表位以增强抗体中和能力或添加CTL抗原表位以增强CTL反应并进一步增强交叉保护[10]。机体在接种流感疫苗后会产生长期的记忆B细胞,但是这些B细胞分泌的抗体特异性强,在面对变异流感病毒时起不到保护作用,所以疫苗能诱导长期存在的记忆T细胞是未来的发展方向,而在疫苗中添加能有效诱导记忆性T细胞的成分则是一个不错的选择。
3.2 佐剂的使用
目前关于流感疫苗的佐剂选择较多,如MF59、QS21、AS02、Rintatolimod等。在提供交叉保护方面,Rintatolimod有较好的潜力,它是一种Toll样受体兴奋剂,会大幅增加机体的分泌型IgA抗体产生,使用不同毒株攻毒时机体交叉保护能力也显著提升[5]。目前也有联合佐剂的应用,以期进一步增加疫苗的有效性。
总结:流感减毒活疫苗可以有效激活固有免疫、CTL反应及分泌IgA抗体。这些因素共同作用使得机体内的免疫保护在具有特异性的同时,还可能具有交叉保护效果。进一步的研究如佐剂、基因工程、蛋白修饰等方法可以进一步提升流感减毒活疫苗的有效性。
最新消息:2021年2月26日,世卫组织正式发布2021-2022北半球流感季疫苗所需包含的流感毒株,以便各国和疫苗厂商研发生产流感疫苗。世卫组织于18日收到俄罗斯在人类临床样本中发现了7例H5N8型禽流感病例的报告。2020年,在保加利亚、捷克、埃及、德国、匈牙利、伊拉克、日本、哈萨克斯坦、荷兰、波兰、罗马尼亚、英国和俄罗斯的禽类和野外鸟类中也发现了H5N8型禽流感病毒。世卫组织表示,未来有可能暴发新的大流行病,正在密切关注潜在的大流行病威胁,确保各国有良好的监测系统,能迅速发现疾病并采取应对措施。流感病毒的变异性仍然是流感疫苗有效性的最大威胁,在通用流感疫苗诞生之前,流感减毒活疫苗的交叉保护机制是目前针对这一问题的最佳解决方案。建议流感减毒活疫苗的下一步技术升级,能在提升其交叉保护机制方面深入研究,扩大交叉保护范围提高交叉免疫效果。
参考文献
[1] Rudenko L, Isakova-Sivak I, Donina S. H7N3 live attenuated influenza vaccine has a potential to protect against new H7N9 avian influenza virus[J]. Vaccine, 2013,31(42):4702-4705.
[2] Rudenko L, Isakova-Sivak I, Rekstin A. H7N9: can H7N3 live-attenuated influenza vaccine be used at the early stage of the pandemic?[J]. Expert Rev Vaccines, 2014,13(1):1-4.
[3] Rekstin A, Isakova-Sivak I, Petukhova G, et al. Immunogenicity and Cross Protection in Mice Afforded by Pandemic H1N1 Live Attenuated Influenza Vaccine Containing Wild-Type Nucleoprotein[J]. Biomed Res Int, 2017,2017:9359276.
[4] Tamura S, Tanimoto T, Kurata T. Mechanisms of broad cross-protection provided by influenza virus infection and their application to vaccines[J]. Jpn J Infect Dis, 2005,58(4):195-207.
[5] Overton E T, Goepfert P A, Cunningham P, et al. Intranasal seasonal influenza vaccine and a TLR-3 agonist, rintatolimod, induced cross-reactive IgA antibody formation against avian H5N1 and H7N9 influenza HA in humans[J]. Vaccine, 2014,32(42):5490-5495.
[6] Tamura S, Funato H, Hirabayashi Y, et al. Functional role of respiratory tract haemagglutinin-specific IgA antibodies in protection against influenza[J]. Vaccine, 1990,8(5):479-485.
[7] Tamura S, Funato H, Hirabayashi Y, et al. Cross-protection against influenza A virus infection by passively transferred respiratory tract IgA antibodies to different hemagglutinin molecules[J]. Eur J Immunol, 1991,21(6):1337-1344.
[8] Jang Y H, Seong B L. Cross-protective immune responses elicited by live attenuated influenza vaccines[J]. Yonsei Med J, 2013,54(2):271-282.
[9] Sekiya T, Mifsud E J, Ohno M, et al. Inactivated whole virus particle vaccine with potent immunogenicity and limited IL-6 induction is ideal for influenza[J]. Vaccine, 2019,37(15):2158-2166.
[10] Isakova-Sivak I, Korenkov D, Smolonogina T, et al. Comparative studies of infectivity, immunogenicity and cross-protective efficacy of live attenuated influenza vaccines containing nucleoprotein from cold-adapted or wild-type influenza virus in a mouse model[J]. Virology, 2017,500:209-217.

来源:Internet


