您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2021-02-18 10:10
更多医药技术资讯,请点击医药专栏:http://drug.anytesting.com/ 欢迎关注文末微信公众号:药研检测drugtest
「 本文共:16条资讯,阅读时长约:3分钟 」
今日头条
NMPA取消8项证明事项。为进一步减证便民、优化服务,国家药监局日前发布关于取消8项证明事项的公告(第四批)(2021年第25号)。公告明确,新药证书、营业执照、生产许可证、药品上市许可持有人证明文件、生物制品批签发合格证等8项证明事项,不再要求申请人提交,改为内部核查或网络核验。
国内药讯
1.华海丙酸氯倍他索外用溶液获FDA批准文号。华海药业丙酸氯倍他索外用溶液的新药简略申请获FDA批准。丙酸氯倍他索外用溶液主要用于以治疗某些皮肤状况引起的瘙痒,发红和肿胀等。该产品原研厂家为Galderma公司。当前美国境内,丙酸氯倍他索外用溶液获批的主要生产厂商有 Sandoz、Perrigo 等,2020 年该药品美国市场销售额约 3,700 万美元。
2.驯鹿医疗CAR-T疗法拟纳入突破性疗法认定。驯鹿医疗申报的全人源BCMA嵌合抗原受体自体T细胞注射液获CDE拟纳入突破性治疗品种,用于治疗复发/难治性多发性骨髓瘤。这款在研CAR-T疗法由驯鹿医疗和信达生物联合开发,以慢病毒为基因载体转染自体T细胞,CAR包含全人源scFv、CD8a铰链和跨膜、4-1BB共刺激和CD3z激活结构域,使该产品具有疗效持久的潜力。
3.复星改良型新药NS002片在美获批临床。复星医药宣布其控股子公司Novelstar收到了FDA关于同意NS002片用于炎性关节病治疗进行临床试验的批复函。NS002片是一款改良型新药,Novelstar公司拟于近期条件具备后于美国开展该新药针对上述适应症的BA临床试验。根据 IQVIA MIDASTM最新数据,2019年度,与该新药同类型药品于全球的销售额约为26亿美元。
4.首个CAR-NK细胞疗法在中国申报临床。国健呈诺生物「靶向间皮素嵌合抗原受体NK细胞注射液」临床试验申请获CDE受理,拟开发用于治疗晚期上皮性卵巢癌。据悉,这是首个在中国申报临床的用于实体瘤治疗的CAR-NK疗法。根据公开资料,国健呈诺生物是由呈诺医学与国亦生命科技共同成立的合资公司,专注于多种肿瘤细胞疗法的开发,以CAR-NK技术为基础,为患者提供规模化现货型抗肿瘤药物。
5.纽福斯生物完成B轮融资。眼科基因药物公司纽福斯生物完成了4亿元人民币的B轮融资。本轮融资由国方资本及华新投资共同领投,现有股东红杉资本中国基金和北极光创投以及园丰资本等机构参投。纽福斯生物目前正在建设眼科遗传病基因治疗研发平台和GMP生产平台。其核心产品NR082(rAAV-ND4,NFS-01)已获FDA孤儿药资格,并在中国申报了临床试验。该公司计划今年启动NR082针对ND4突变相关的LHON适应症临床试验,同时加快苏州商业化生产基地的建设。
国际药讯
1.礼来新冠中和抗体组合获FDA紧急使用授权。FDA授予礼来(Eli Lilly)中和抗体联合疗法——bamlanivimab(LY-CoV555)700 mg和etesevimab(JS016或LY-CoV016)1400 mg紧急使用授权(EUA),用于治疗12岁及以上高风险的轻中度COVID-19非住院患者。一项Ⅲ期BLAZE-1试验结果表明,这一组合降低COVID-19住院和死亡风险70%。值得一提的是,FDA此前已授予Bamlanivimab用于静脉输液(60分钟)治疗轻中度COVID-19非住院患者的紧急使用授权,此次FDA的授权允许该新药单药以及组合疗法的输注时间分别缩短至16分钟或21分钟。
2.再生元ANGPTL3 靶向疗法Evkeeza获FDA批准。再生元(Regeneron) “first-in-class”降脂疗法Evkeeza(evinacumab-dgnb)获FDA批准,与其它降低低密度脂蛋白胆固醇(LDL-C)的疗法联用,治疗12岁以上纯合子家族性高胆固醇血症(HoFH)患者。Evkeeza也是FDA批准的首款ANGPTL3靶向疗法。在一项Ⅲ期临床ELIPSE中,与对照组相比,Evkeeza组患者24周后的LDL-C水平降低了49%(p<0.0001)。详细结果已发表在《新英格兰医学杂志》上。
3.罗氏IL-6抑制剂降低新冠住院患者死亡风险。罗氏类风湿关节炎治疗药物tocilizumab在评估治疗COVID-19的一系列潜在疗法的英国大型临床RECOVERY中获积极结果。与常规治疗相比,tocilizumab显著降低COVID-19住院患者的死亡风险(29%vs33%,p=0.007),提高患者的出院率(54%vs47%,p<0.001),降低患者使用机械通气或者死亡风险(33%vs38%,p=0.0005)。结合此前对全身性类固醇疗法的研究结果,地塞米松与tocilizumab联用能够将患者(需要氧疗并伴有显著炎症)的死亡率降低三分之一;将机械通气患者的死亡率降低接近一半。
4.“first-in-class”抗体偶联药物Ⅲ期临床结果发布。Seagen公司与安斯泰来联合开发的nectin-4靶向抗体偶联药物Padcev(enfortumab vedotin-ejfv)在治疗局部晚期或转移性尿路上皮癌的Ⅲ期临床中获积极结果。发布在NEJM的数据显示,在中位随访时间达到11个月时,与化疗相比,Padcev将患者死亡风险降低30%;将患者疾病进展或死亡的风险降低38%;确认总缓解率为40.6%,疾病控制率达到71.9%。两家公司将向FDA递交监管申请,寻求将加速批准转为完全批准。
5.Keytruda组合一线治疗肾细胞癌Ⅲ期结果积极。默沙东PD-1抑制剂Keytruda与卫材酪氨酸激酶抑制剂Lenvima联用,在一线治疗晚期肾细胞癌(RCC)的关键性Ⅲ期临床中获积极结果。与sunitinib相比,该组合使疾病进展或死亡的风险降低61%(HR=0.39,95% CI:0.32-0.49,p<0.001),两组中位PFS分别为23.9个月和9.2个月;使死亡风险降低34%,中位随访为27个月时,两组中位OS均未达到;显著提高了患者的ORR(71.0%vs36.1%)。此外Lenvima与everolimus联用也显著改善了患者的PFS和ORR。详细结果已发表于《新英格兰医学杂志》上。
6.Opdivo组合一线治疗肾细胞癌Ⅲ期数据更新。百时美施贵宝公司(BMS)PD-1抑制剂Opdivo(nivolumab)联合Exelixis公司酪氨酸激酶抑制剂Cabometyx(cabozantinib)一线治疗晚期肾细胞癌(RCC)关键Ⅲ期CheckMate-9ER试验的新分析结果在ASCO-GU 2021年会上公布。中位随访时间为23.5个月时,与Sutent相比,Opdivo+Cabometyx在全部疗效终点均表现出显著改善,包括无进展生存期(17.0个月vs8.3个月;HR=0.52;95%CI:0.43-0.64)、总生存期(HR=0.66;95%CI:0.50-0.87)、客观缓解率(54.8%vs28.4%)等。长期随访未发现新的安全性信号。
7.蓝鸟生物暂停LentiGlobin基因疗法临床研究。蓝鸟生物(bluebird bio)宣布由于两例参加其细胞疗法LentiGlobinⅠ/Ⅱ期临床HGB-206的镰刀状细胞贫血症(SCD)患者分别被诊断出罹患急性髓细胞白血病(AML)和骨髓细胞异常增生症(MDS),该公司叫停了LentiGlobin用于镰状细胞疾病(SCD)的Ⅰ/Ⅱ期(HGB-206)和Ⅲ期(HGB-210)临床研究。目前,相关调查正在进行,以确定是否与其生产中使用BB305慢病毒载体存在任何关系。此外,该公司也暂停使用同样慢病毒载体BB305已在欧洲上市的地中海贫血细胞疗法Zynteglo的销售。
医药热点
1.法国医疗系统通知准备进入危机组织状态。据法国多家媒体报道,法国公共卫生署近期发出一份通知,要求各地区公共卫生署和相关医院、诊所准备从2月18日开始进入危机组织状态。该通知称,由于目前法国境内的变异新冠病毒传播速度很快,法国目前的疫情状况让人担忧,希望各地卫生部门能提前准备,动员一切人员和手段,应对可能出现的疫情反弹。
2.美国目前已发现7种新冠病毒变异株。发布于美国多个机构及大学的一篇名为《2020年末多个影响677号氨基酸的蛋白变体SARS-CoV-2变异株出现》的学术论文显示,美国目前已发现了7种新冠病毒变异株。由于美国仅对不到1%的新冠病毒样本进行了基因测序,目前尚无法确定这些病毒变异株是否更具有传染性。
3.英国:糖尿病首要死因为癌症。《柳叶刀-糖尿病与内分泌学》最新发表来自伦敦帝国理工学院团队的研究,对30多万例糖尿病患者长达18年的研究表明,心血管问题已不再是糖尿病患者死亡的主要原因,而癌症、痴呆症、肝病等问题正在对糖尿病患者的生命造成更大的威胁。根据研究结果,糖尿病患者的3大类死因分别为癌症、心血管疾病和痴呆症,所占糖尿病死亡病例的比例分别28%、25%和16%。
股市资讯
【君实生物】(1)FDA批准公司的合作伙伴美国礼来制药公司的在研抗体药物Etesevimab (JS016/LY-CoV016)1400mg及Bamlanivimab (LY-CoV555)700mg双抗体疗法的紧急使用授权。该疗法被授予用于治疗伴有进展为重度新型冠状病毒肺炎及/或住院风险的12岁及以上轻中度COVID-19患者。(2)XPO1抑制剂JS110获得药物临床试验申请受理。(3)抗TIGIT单抗注射液临床试验申请获得FDA批准。
【复星医药】控股子公司Novelstar新药NS002片获得美国FDA药品临床试验批准,用于治疗炎性关节病。
【海思科】创新药环泊酚注射液新适应症注册申请获得受理。
审评动向
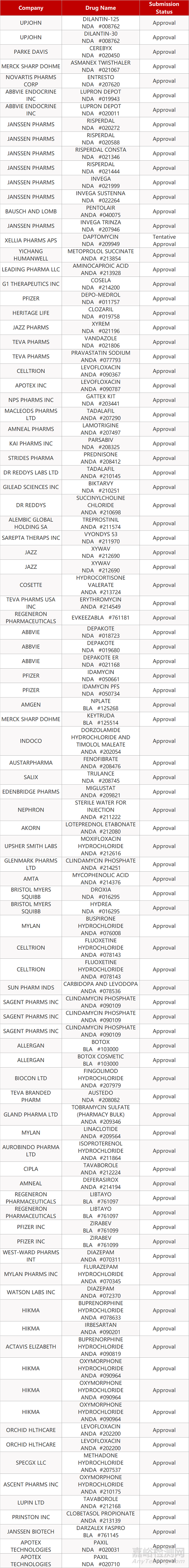
2. FDA最新获批情况(北美02月16日)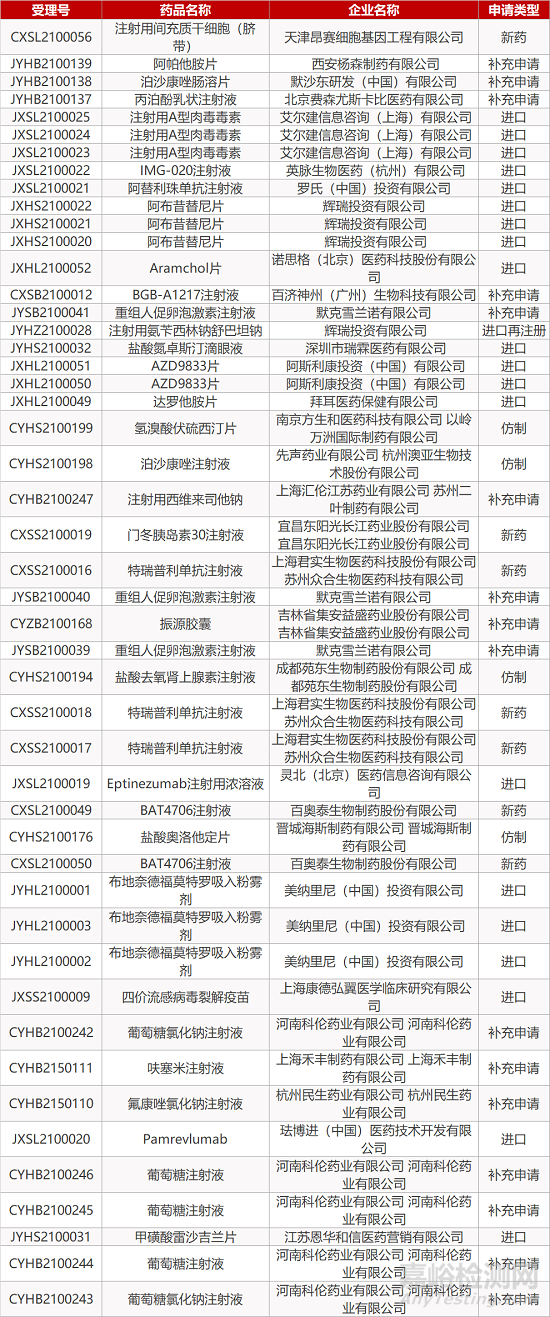
- The End -

来源:药研发


