您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2020-12-22 09:14
更多医药技术资讯,请点击医药专栏:http://drug.anytesting.com/ 欢迎关注文末微信公众号:药研检测drugtest
「 本文共:15条资讯,阅读时长约:3分钟 」
今日头条
国内药讯
1.双成药业注射用胸腺法新首家通过一致性评价。双成药业「注射用胸腺法新」获国家药监局批准通过一致性评价,为该品种首家通过一致性评价的仿制药。胸腺法新是一款胸腺肽类免疫调节剂,用于治疗慢性病毒感染、肿瘤及免疫缺陷病人的辅助治疗。公开数据显示,2018年中国公立医疗机构终端注射用胸腺法新销售额为29.08亿元,其中原研占据50.58%的市场份额。包括原研赛生药业在内,该品种国内已有 17 家企业获得文号。
2.国药集团酒石酸布托啡诺注射液申报上市。国药集团国瑞药业的酒石酸布托啡诺注射液仿制3类上市申请获CDE受理。米内网数据显示,近两年中国公立医疗机构终端布托啡诺注射剂增速均超过30%,销售额超过15亿元;今年上半年同比下滑2.16%,生产企业仅有恒瑞医药一家。截至目前,酒石酸布托啡诺注射液仅有国药集团国瑞药业以仿制3类报产,获批后将视同过评。
3.德琪合作抗癌新药中国获批Ⅲ期临床。NMPA批准德琪医药口服型选择性核输出抑制剂ATG-010(selinexor)与硼替佐米、地塞米松联合治疗中国复发难治性多发性骨髓瘤(MM)患者的Ⅲ期临床试验申请。ATG-010是Karyopharm公司与德琪医药的合作品种,值得一提的是,该新药刚刚已获FDA批准新适应症上市申请(sNDA)——与硼替佐米和低剂量地塞米松联合治疗既往接受过至少一线治疗的成人MM患者。
4.金赛药业金妥利珠单抗在美获批临床。长春高新旗下金赛药业金妥利珠单抗注射液用于进展期血液系统恶性肿瘤(急性髓系白血病和骨髓增生异常综合征)的临床试验申请获FDA批准。据悉,这是一款CD47单抗,已于今年9月以注册分类1类生物新药在中国获得两项临床试验默示许可,拟开发用于晚期恶性实体瘤和淋巴瘤,以及血液系统恶性肿瘤。
5.武田血友病A管理工具在中国获批上市。武田旗下药代动力学(PK)指导下的血友病A管理工具myPKFiT在中国正式上市,供熟悉血友病A治疗的执业医疗专业人士(HCP)使用,辅助16岁及以上(体重45 kg及以上)血友病A患者接受百因止(注射用重组人凝血因子VIII)的预防治疗。myPKFiT也是中国首个且目前唯一获NMPA批准支持血友病A PK指导下的管理工具,与百因止配合使用,可降低出血风险,助力患者实现“零出血”的治疗目标。
国际药讯
1.Karyopharm口服型SINE化合物获FDA批准新适应。FDA批准Karyopharm公司全球首创SINE化合物XPOVIO®(selinexor,ATG-010)的新适应症上市申请,与硼替佐米和低剂量地塞米松联合治疗既往接受过至少一线治疗的成人多发性骨髓瘤患者。XPOVIO®是全球唯一一款口服型SINE化合物,此前已获批联合低剂量地塞米松用于四线治疗复发难治性多发性骨髓瘤患者;以及作为单药用于治疗复发难治性弥漫性大B细胞淋巴瘤患者。德琪医药拥有XPOVIO®包括中国在内的亚太地区的独家开发和商业化授权。
2.安进美罗华生物类似药RIABNI获FDA批准。FDA批准安进(Amgen)利妥昔单抗(美罗华®,rituximab,罗氏公司)生物类似药RIABNI™ (rituximab-arrx)上市,用于治疗成人非霍奇金淋巴瘤,慢性淋巴细胞性白血病,肉芽肿性多血管炎(韦格纳氏肉芽肿病)和显微镜下多血管炎(MPA)。RIABNI将于明年1月开始销售,批发采购价(WAC或标价)将比同类产品美罗华低23.7%,平均售价(ASP)比美罗华低16.7%,与辉瑞Ruxience®价格相近。RIABNI的标价分别为716.8美元/100 mg和3,584美元/500 mg的单剂瓶装。
3.首款晚期前列腺癌口服激素疗法Orgovyx获FDA批准。FDA批准Myovant公司开发的口服GnRH受体拮抗剂Orgovyx(relugolix)上市,用于治疗晚期前列腺癌成人患者。这也是首个用于治疗这类患者的口服激素疗法。在一项临床试验中,与醋酸亮丙瑞林相比,Orgovyx显著提高雄激素敏感性晚期前列腺癌男性患者的睾酮持续抑制水平达到去势水平(<50 ng/dL)的患者比例(96.7%vs88.8%),达到主要疗效终点。
4.IBAT抑制剂启动罕见遗传疾病全球Ⅲ期研究。Albireo Pharma公司宣布启动非全身性IBAT抑制剂odevixibat治疗罕见胆汁淤积性肝病Alagille综合征的国际Ⅲ期研究ASSERT,评估odevixibat 120 µg/(kg•d)治疗24周对缓解ALGS患者瘙痒症状的疗效和安全性。次要终点将测定血清胆汁酸水平以及安全性和耐受性。该项研究预计将在北美、欧洲、中东和亚太地区的35个研究中心入组约45例0~17岁经基因检测确诊为ALGS的患者。
5.Keytruda组合疗法获FDA优先审评资格。FDA受理默沙东重磅PD-1抑制剂Keytruda的补充生物制品许可申请,与化疗联用一线治疗局部晚期不可切除性或转移性食管癌和胃食管连接部癌患者。FDA同时授予其优先审评资格。预计于明年4月13日之前做出回复。在一项关键性Ⅲ期临床KEYNOTE-590中,在中位随访为10.8个月时,Keytruda组合疗法与化疗相比,将患者死亡风险降低27%(HR=0.73,95% CI,0.62-0.86,p<0.0001)。两组患者中位OS分别达到12.4个月和9.8个月。
6.诺华RNAi降脂药inclisiran遭FDA推迟批准。诺华新型RNAi降脂疗法inclisiran收到FDA的完整回复函(CRL)。FDA认为,该疗法位于欧洲的生产工厂尚未解决此前在审查资料时发现的与生产工艺相关的一些问题。在欧盟,该疗法已于12月11日获批用于治疗成人高胆固醇血症及混合性血脂异常。一项ORION研究结果显示,对于使用最大耐受剂量他汀类药物治疗后LDL-C仍无法达标的患者,Inclisiran可使LDL-C下降达52%。
医药热点
1.新冠疫苗成为《科学》十大突破首位。美国《科学》杂志17日公布其评选的2020年十大科学突破,“以创纪录的速度开发和测试急需的新冠疫苗”当选头号突破。其他9项科学突破分别是:基因编辑工具CRISPR首次临床治愈遗传性血液疾病、人工智能预测蛋白质结构、“带毒”生存时间长的艾滋病病毒感染者病毒特殊位置的发现、更清晰的全球变暖预测、快速射电暴来源新发现、古代洞穴壁画描绘世界上最古老的狩猎场景、室温超导的实现、鸟类智力研究新进展以及科学家呼吁关注种族歧视问题。
2.瑞金医院消化道肿瘤临床诊疗中心开工。上海交通大学医学院附属瑞金医院消化道肿瘤临床诊疗中心项目开工仪式于19日在瑞金医院隆重举行, 该项目总建筑面积60000平方米,地上23层,地下3层,设置床位500张。消化道肿瘤临床诊疗中心将以“多学科联合诊疗(MDT)”、“一站式” 诊疗服务为特色,将“临床医疗、科技创新、教学培训”集成一体,旨在建成具有全球影响力的临床医学创新中心,以及打造具有精准医学特色的一体化诊疗中心。
3.FDA就多起接种新冠疫苗的不良反应报告展开调查。据新西兰中文先驱网报道,当地时间19日,FDA正在对接种辉瑞新冠疫苗后,有接种者出现过敏反应的情况展开调查。目前并不确定是什么原因引起不良反应,但报道指出,辉瑞以及莫德纳公司生产的新冠疫苗中存在一种叫聚乙二醇的化学物,可能是罪魁祸首。
股市资讯
【恒瑞医药】子公司瑞石生物医药有限公司药品“RS1805片(规格50mg、200mg)”临床试验获批。
【昆药集团】公司收到盐酸法舒地尔注射液的药品注册证。
【华海药业】子公司华奥泰“HB0025注射液”临床申请获FDA批准。
审评动向
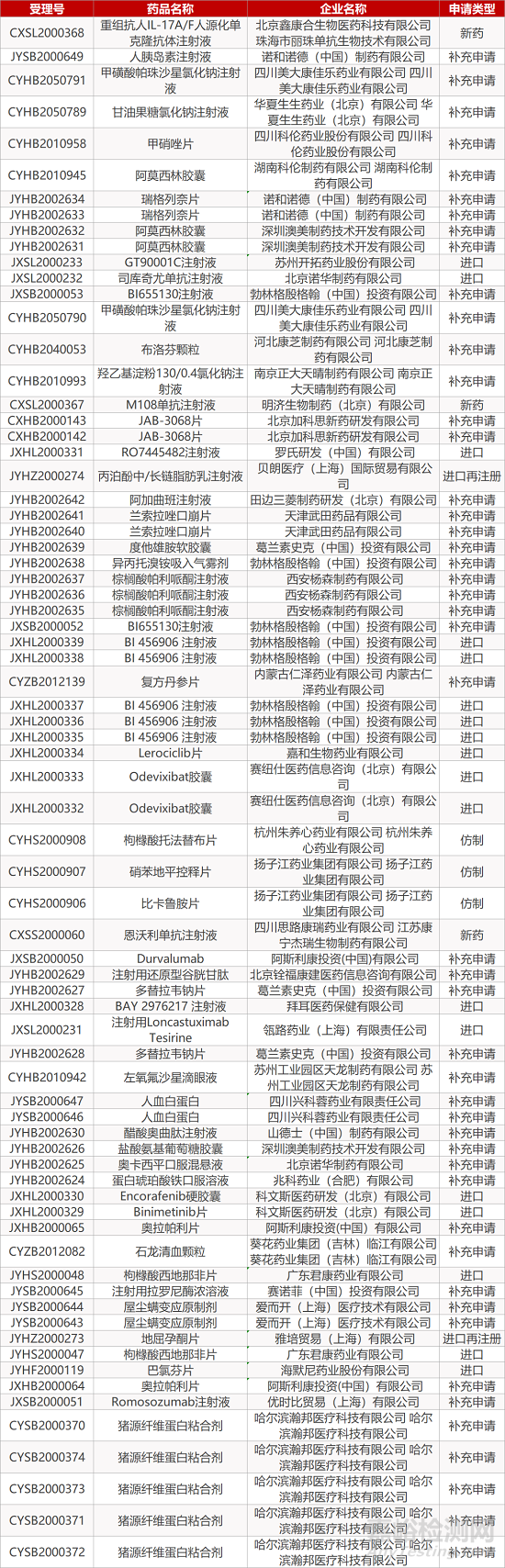
1. CDE最新受理情况(12月21日)
- The End -

来源:未知


